填空题 适中0.65 引用1 组卷11
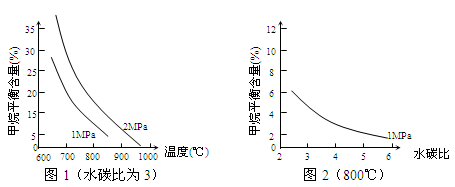
我国天然气储存量丰富,可用于合成水煤气,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)已知温度、压强和水碳比
CO(g)+3H2(g)已知温度、压强和水碳比 对甲烷平衡含量[
对甲烷平衡含量[ (CH4)]的影响如图:
(CH4)]的影响如图:
(1)工业上选择高温条件,理由是______________________________ 。
(2)已知:在700℃,1MPa时,1molCH4与1molH2O在2L的密闭容器中反应,6min达到平衡,此时CH4的转化率为80%,则0-6min H2的平均反应速率为v(H2)=_______ 。假设反应开始时容器内气体总压强为p0,则平衡时气体的总压强p =__________ (结果用p0的代数式表示)
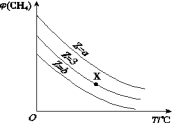
(3)在恒压下,平衡时CH4的体积分数与Z(水碳比 )和T(温度)的关系如图所示,图中三条线Z的大小关系为
)和T(温度)的关系如图所示,图中三条线Z的大小关系为________________ (填a、b与3的大小关系)。温度不变时,图中X点对应的平衡在加压后 (CH4)
(CH4)__________ (填“增大”、“减小”或“不变”)。
(4)为了提高甲烷的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有________________ 。
(5)在700℃时,反应达到平衡后再向其中加入1.0 mol CH4、1.0 mol H2O、1.0 mol CO和1.0 mol H2 ,此时的v正__________ v逆(填“>”“<”或“=”),理由是_____________ 。
 CO(g)+3H2(g)已知温度、压强和水碳比
CO(g)+3H2(g)已知温度、压强和水碳比
(1)工业上选择高温条件,理由是
(2)已知:在700℃,1MPa时,1molCH4与1molH2O在2L的密闭容器中反应,6min达到平衡,此时CH4的转化率为80%,则0-6min H2的平均反应速率为v(H2)=
(3)在恒压下,平衡时CH4的体积分数与Z(水碳比
(4)为了提高甲烷的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有
(5)在700℃时,反应达到平衡后再向其中加入1.0 mol CH4、1.0 mol H2O、1.0 mol CO和1.0 mol H2 ,此时的v正
18-19高二下·黑龙江大庆·开学考试
类题推荐
回收利用CO2有助于降低碳排放。回答下列问题:
Ⅰ.工业上,利用CO2和NH3合成尿素。化学原理为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH。已知:该反应的平衡常数与温度关系如下表所示。
CO(NH2)2(s)+H2O(g) ΔH。已知:该反应的平衡常数与温度关系如下表所示。
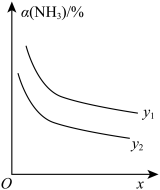
(1)在一定条件下,合成尿素反应达到平衡时,氨气平衡转化率与温度、压强关系如图所示。x代表_____________ ,理由是_______ ;y1_________ y2(填“>”“<”或“=”)。
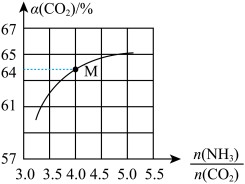
(2)在一定温度和压强下,原料气中NH3和CO2的物质的量之比(氨碳比)与CO2的平衡转化率(α)的关系如图所示。
①合成CO(NH2)2反应中,氨碳比越大,氨的平衡转化率越_____ (填“大”或“小”)。
②M点对应NH3的平衡转化率为_______________ 。
(3)在温度为T ℃时,向1 L恒容密闭容器中充入1.5 mol NH3和0.5 mol CO2,达到平衡时,容器内压强等于开始时的75%,则T ℃时该反应的平衡常数K为_____ L2·mol2。
Ⅱ.利用CO2和H2合成甲醇。
(4)已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,v正=k正•p(CO2)•p3(H2),v逆=k逆•p(CH3OH)•p(H2O),k正、k逆表示速率常数,只与温度有关。当反应达到平衡后,升高温度,
CH3OH(g)+H2O(g) ΔH<0,v正=k正•p(CO2)•p3(H2),v逆=k逆•p(CH3OH)•p(H2O),k正、k逆表示速率常数,只与温度有关。当反应达到平衡后,升高温度, 将
将________ (填“增大”“减小”或“不变”)。
(5)已知:①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.6 kJ·mol1,②2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l) ΔH2=-1453 kJ·mol1,则CO2(g)+3H2(g)=CH3OH(l)+H2O(l)ΔH=
__ kJ·mol1。
Ⅲ.工业生产中,可以用CO2除去残留Ca(OH)2。
(6)常温下,向含Ca(OH)2的废液中通入CO2,当c(CO32)=____ mol·L1时,c(Ca2)=1.0×105mol·L1。[常温下,Ksp(CaCO3)=4.96×109]
Ⅰ.工业上,利用CO2和NH3合成尿素。化学原理为2NH3(g)+CO2(g)
| t/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
(2)在一定温度和压强下,原料气中NH3和CO2的物质的量之比(氨碳比)与CO2的平衡转化率(α)的关系如图所示。
①合成CO(NH2)2反应中,氨碳比越大,氨的平衡转化率越
②M点对应NH3的平衡转化率为
(3)在温度为T ℃时,向1 L恒容密闭容器中充入1.5 mol NH3和0.5 mol CO2,达到平衡时,容器内压强等于开始时的75%,则T ℃时该反应的平衡常数K为
Ⅱ.利用CO2和H2合成甲醇。
(4)已知CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0,v正=k正•p(CO2)•p3(H2),v逆=k逆•p(CH3OH)•p(H2O),k正、k逆表示速率常数,只与温度有关。当反应达到平衡后,升高温度,
CH3OH(g)+H2O(g) ΔH<0,v正=k正•p(CO2)•p3(H2),v逆=k逆•p(CH3OH)•p(H2O),k正、k逆表示速率常数,只与温度有关。当反应达到平衡后,升高温度,(5)已知:①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.6 kJ·mol1,②2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l) ΔH2=-1453 kJ·mol1,则CO2(g)+3H2(g)=CH3OH(l)+H2O(l)ΔH=
Ⅲ.工业生产中,可以用CO2除去残留Ca(OH)2。
(6)常温下,向含Ca(OH)2的废液中通入CO2,当c(CO32)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网