解答题-实验探究题 0.4 引用1 组卷376
亚硝酰硫酸(NOSO4H)是一种浅黄色或蓝紫色液体,遇水分解,溶于浓硫酸不分解,主要用于染料、医药领域的重氮化反应中取代亚硝酸钠。亚硝酰硫酸能有效降低硫酸使用量,增加反应的流动性,不产生无机盐,从而可以降低成本,提高产品质量,使染料成品色泽鲜艳、固色能力强,并减少污水。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。
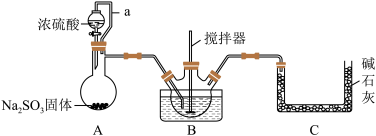
(1)简述检验装置A的气密性操作______ 。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20 ℃,故可将三颈烧瓶置于____ 中。
②开始时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是______ 。
③该实验装置存在导致NOSO4H产量降低的缺陷,请提出改进方案_____ 。
④利用装置A制备SO2 ,下列试剂最适宜的是______ 。
A.Na2SO3固体和20%硝酸 B.Na2SO3固体和20%硫酸
C.Na2SO3固体和70%硫酸 D.Na2SO3固体和98%硫酸
⑤已知亚硝酸不稳定,易分解,发生反应2HNO2=NO2↑+NO↑+H2O。请写出NOSO4H遇水分解时发生反应的化学方程式______ 。
(3)测定亚硝酰硫酸NOSO4H的纯度。
准确称取1.380 g产品放入250 mL的碘量瓶中,加入60.00 mL0.1000 mol·L-1KMnO4标准溶液和10 mL 25%的H2SO4溶液,然后摇匀(过程中无气体产生)。用0.2500 mol·L-1的草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4。
①简述该操作达到滴定终点时的现象______ 。
②亚硝酰硫酸的纯度为______ 。

(1)简述检验装置A的气密性操作
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20 ℃,故可将三颈烧瓶置于
②开始时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是
③该实验装置存在导致NOSO4H产量降低的缺陷,请提出改进方案
④利用装置A制备SO2 ,下列试剂最适宜的是
A.Na2SO3固体和20%硝酸 B.Na2SO3固体和20%硫酸
C.Na2SO3固体和70%硫酸 D.Na2SO3固体和98%硫酸
⑤已知亚硝酸不稳定,易分解,发生反应2HNO2=NO2↑+NO↑+H2O。请写出NOSO4H遇水分解时发生反应的化学方程式
(3)测定亚硝酰硫酸NOSO4H的纯度。
准确称取1.380 g产品放入250 mL的碘量瓶中,加入60.00 mL0.1000 mol·L-1KMnO4标准溶液和10 mL 25%的H2SO4溶液,然后摇匀(过程中无气体产生)。用0.2500 mol·L-1的草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4。
①简述该操作达到滴定终点时的现象
②亚硝酰硫酸的纯度为
20-21高三上·浙江绍兴·阶段练习


