解答题-实验探究题 适中0.65 引用2 组卷520
甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组用如图装置制备甘氨酸亚铁, (夹持仪器已省略)。
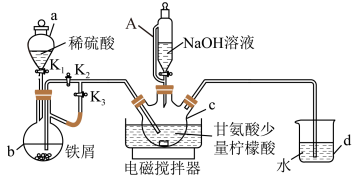
有关物质性质如表:
实验步骤如下:
I. 打开K1和K3,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入到c中。
II. 在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调节溶液pH至5.5左右,使反应物充分反应。
III.反应完成后,向c中反应混合物中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得到粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器a的名称是________ ;与a相比,仪器A的优点是_______ 。d装置的作用是________ 。
(2)步骤Ⅰ中将b中溶液加入到c中的具体操作是_____ ;步骤II中若调节pH偏高,则所得粗产品中会混有的杂质______ ;(写化学式)。
(3) c中生成甘氨酸亚铁的化学方程式是_________ 。
(4)下列关于该实验的说法错误的是_____ (填写序号)。
a. 步骤Ⅰ中可由d中导管冒出气泡的快慢来判断装置中的空气是否排尽
b. 反应混合液中加入柠檬酸的作用是防止Fe2+被氧化
c. 步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
d. 步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5)反应开始前c中加入的甘氨酸为0.2 mol,本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____ %。

有关物质性质如表:
| 甘氨酸(H2NCH2COOH) | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸中的溶解度大于在乙醇中的溶解度 |
| 柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性 |
| 甘氨酸亚铁 | 易溶于水,难溶于乙醇、冰醋酸 |
实验步骤如下:
I. 打开K1和K3,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入到c中。
II. 在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调节溶液pH至5.5左右,使反应物充分反应。
III.反应完成后,向c中反应混合物中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得到粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器a的名称是
(2)步骤Ⅰ中将b中溶液加入到c中的具体操作是
(3) c中生成甘氨酸亚铁的化学方程式是
(4)下列关于该实验的说法错误的是
a. 步骤Ⅰ中可由d中导管冒出气泡的快慢来判断装置中的空气是否排尽
b. 反应混合液中加入柠檬酸的作用是防止Fe2+被氧化
c. 步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
d. 步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5)反应开始前c中加入的甘氨酸为0.2 mol,本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是
20-21高三上·山东济南·阶段练习
类题推荐
有一种新型补铁剂由甘氨酸与硫酸亚铁制取。某化学学习小组用如图所示装置(夹持仪器省略)制备补铁剂甘氨酸亚铁 。
。
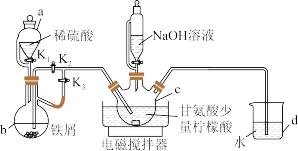
有关物质性质如下表所示:
实验步骤如下:
Ⅰ.打开 、
、 ,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入c中。
,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器c的名称是_______ ,d的作用是_______ 。
(2)步骤Ⅰ中将b中溶液加入c中的操作是_______ ;步骤Ⅱ中若调节溶液pH偏高,则所得粗产品中会混有一种杂质,该杂质为_______ 。
(3)c中生成甘氨酸亚铁的化学方程式是_______ 。
(4)下列关于该实验的说法不正确的是_______ 。
A.步骤Ⅰ中当观察到d中导管冒出气泡,则表示装置内空气已排尽
B.步骤Ⅰ、步骤Ⅱ加液时,无须打开分液漏斗上方的活塞
C.反应混合液中加入柠檬酸的作用是防止 水解及被氧化
水解及被氧化
D.步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
E.步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5) 的配位化合物较为稳定且运用广泛,常见配离子及其在水溶液中的颜色如下表
的配位化合物较为稳定且运用广泛,常见配离子及其在水溶液中的颜色如下表
为探究配合物形成的影响因素,某同学按如下步骤完成实验:

为了能观察到溶液I中 的颜色,应加入的试剂为
的颜色,应加入的试剂为_______ ;从实验②和③可知配体的配位能力强弱顺序_______ (填化学式)。
结论:该实验中影响配合物形成的因素有溶液的酸碱性、_______ 。

有关物质性质如下表所示:
| 甘氨酸( | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸中的溶解度大于在乙醇中的溶解度 |
| 柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性。 |
| 甘氨酸亚铁 | 溶于水,难溶于乙醇、冰醋酸。 |
Ⅰ.打开
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器c的名称是
(2)步骤Ⅰ中将b中溶液加入c中的操作是
(3)c中生成甘氨酸亚铁的化学方程式是
(4)下列关于该实验的说法不正确的是
A.步骤Ⅰ中当观察到d中导管冒出气泡,则表示装置内空气已排尽
B.步骤Ⅰ、步骤Ⅱ加液时,无须打开分液漏斗上方的活塞
C.反应混合液中加入柠檬酸的作用是防止
D.步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
E.步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5)
| 配离子 | ||||
| 颜色 | 浅紫色 | 黄色 | 红色 | 无色 |

为了能观察到溶液I中
结论:该实验中影响配合物形成的因素有溶液的酸碱性、
甘氨酸亚铁[(NH2CH2COO)2Fe]是一种新型补铁剂,广泛用于缺铁性贫血的预防和治疗。某化学学习小组用如图所示装置(夹持仪器省略)制备甘氨酸亚铁。
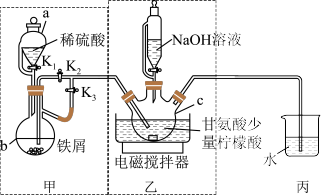
有关物质性质如表所示:
实验步骤如下:
Ⅰ.通过甲装置产生的气体赶尽仪器c中空气后,将仪器b中溶液加入到仪器c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向仪器c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向仪器c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器b的名称是_______ , 丙装置的作用是_______ 。
(2)步骤Ⅰ中赶尽仪器c中空气的具体操作是_______ ,将仪器b中溶液加入到仪器c中的操作是_______
(3)步骤Ⅱ中若调节溶液pH偏高,则所得粗产品中会混有杂质_______ 。(写化学式)
(4)仪器c中生成甘氨酸亚铁的化学方程式是_______ 。
(5)原料中柠檬酸的作用是_______ ,步骤Ⅲ中洗涤沉淀时使用的洗涤剂是_______ (填物质名称),粗产品纯化的操作名称是_______
(6)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。其原因是_______

有关物质性质如表所示:
| 甘氨酸(NH2CH2COOH) | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸中溶解度大于在乙醇中的溶解度 |
| 柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性 |
| 甘氨酸亚铁 | 易溶于水,难溶于乙醇、冰醋酸 |
Ⅰ.通过甲装置产生的气体赶尽仪器c中空气后,将仪器b中溶液加入到仪器c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向仪器c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向仪器c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器b的名称是
(2)步骤Ⅰ中赶尽仪器c中空气的具体操作是
(3)步骤Ⅱ中若调节溶液pH偏高,则所得粗产品中会混有杂质
(4)仪器c中生成甘氨酸亚铁的化学方程式是
(5)原料中柠檬酸的作用是
(6)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。其原因是
甘氨酸亚铁[(H2NCH2COO)2Fe]是一种用于治疗缺铁性贫血的药物,用如图装置可以在实验室中制备甘氨酸亚铁:
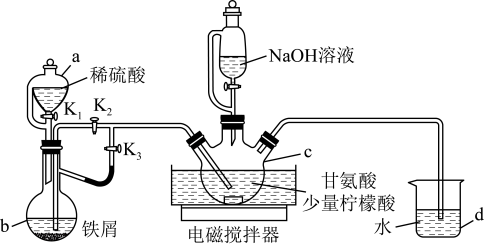
有关物质性质如表所示:
实验步骤如下:
Ⅰ.打开K1、K3,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入到c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加适量NaOH溶液调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向c中反应混合液中加入无水乙醇,析出沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器b的名称是_______ ,d的作用是_______ 。
(2)步骤Ⅰ中将b中溶液加入到c中的操作是关闭_______ 打开_______ (填“K2”或“K3”);步骤Ⅱ中若调节溶液pH偏高,则所得粗产品中会混有杂质_______ (写化学式)。
(3)c中生成甘氨酸亚铁的化学方程式是_______ 。
(4)下列关于该实验的说法正确的是_______ (填字母)。
a.反应混合液中加入柠檬酸的作用是防止Fe2+被氧化
b.步骤Ⅰ中可由d中导管是否还有气泡冒出来判断装置中的空气是否排尽
c.步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
d.步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5)工业上常用高氯酸(不与冰醋酸反应)标准溶液在非水体系中滴定甘氨酸的方法测定产品中的甘氨酸的含量。滴定过程中下列操作会使甘氨酸的测定结果偏高的是_______ (填字母)。
a.滴定时未用高氯酸标准溶液润洗滴定管
b.读数时,滴定前平视,滴定后俯视
c.摇动锥形瓶时有液体溅出
d.滴定前滴定管尖嘴处有气泡,滴定后消失

有关物质性质如表所示:
| 甘氨酸(H2NCH2COOH) | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸中溶解度大于在乙醇中的溶解度。 |
| 柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性。 |
| 甘氨酸亚铁 | 易溶于水且在水中难电离,难溶于乙醇、冰醋酸。 |
Ⅰ.打开K1、K3,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入到c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加适量NaOH溶液调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向c中反应混合液中加入无水乙醇,析出沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器b的名称是
(2)步骤Ⅰ中将b中溶液加入到c中的操作是关闭
(3)c中生成甘氨酸亚铁的化学方程式是
(4)下列关于该实验的说法正确的是
a.反应混合液中加入柠檬酸的作用是防止Fe2+被氧化
b.步骤Ⅰ中可由d中导管是否还有气泡冒出来判断装置中的空气是否排尽
c.步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
d.步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5)工业上常用高氯酸(不与冰醋酸反应)标准溶液在非水体系中滴定甘氨酸的方法测定产品中的甘氨酸的含量。滴定过程中下列操作会使甘氨酸的测定结果偏高的是
a.滴定时未用高氯酸标准溶液润洗滴定管
b.读数时,滴定前平视,滴定后俯视
c.摇动锥形瓶时有液体溅出
d.滴定前滴定管尖嘴处有气泡,滴定后消失
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


