解答题-原理综合题 适中0.65 引用1 组卷97
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50 mL密度为1.1 g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如下图所示。
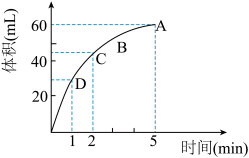
请依图回答下列问题:
(1)放出一半气体所需要的时间为_________________ ;
(2)A、B、C、D各点反应速率快慢的顺序是__________________ ;
(3)在5min后,收集到的气体体积不再增加,原因是______________________ ;
(4)过氧化氢溶液的初始物质的量浓度为__________ mol•L-1(保留两位有效数字)。
(5)在2L的密闭容器中充入一定量的SO3 气体,在一定温度和催化剂作用下,发生反应:2SO3 2SO2+O2,4min时达平衡状态,测得n(O2)=0.8mol,n(SO3)=6.4mol。求:氧气的生成速率v(O2)
2SO2+O2,4min时达平衡状态,测得n(O2)=0.8mol,n(SO3)=6.4mol。求:氧气的生成速率v(O2)_______ mol/(L·min),SO3的转化率______ ,此温度下平衡常数K=_______ 。

请依图回答下列问题:
(1)放出一半气体所需要的时间为
(2)A、B、C、D各点反应速率快慢的顺序是
(3)在5min后,收集到的气体体积不再增加,原因是
(4)过氧化氢溶液的初始物质的量浓度为
(5)在2L的密闭容器中充入一定量的SO3 气体,在一定温度和催化剂作用下,发生反应:2SO3
20-21高二上·安徽六安·阶段练习
类题推荐
I.SO2在工农业生产中有着重要的应用,请回答下列问题:
(1)工业上用软锰矿(主要成分为MnO2)制备Mn(H2PO4)2•2H2O。常用稀硫酸酸浸软锰矿,同时通入SO2,此时发生反应的离子方程式为_____ ,SO2作_____ (填“氧化剂”或“还原剂”)。
Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入2molSO2和1molO2,在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
(2)下列说法能够判断上述反应达到化学平衡状态的是_____ (填标号)。
(3)上述反应体系的正反应速率和逆反应速率相等的时间段是_____ (填“0~4”、“4~8”、“8~12”“12~18”或“18~25”)min。
(4)0~8min内,用SO3表示该反应的平均速率为_____ mol•L-1•min-1,12min时,SO2的转化率为_____ 。
(5)若起始时容器内压强为p0MPa,则平衡时,容器内压强约为_____ (用含p0的代数式表示,保留2位有效数字)MPa。
(1)工业上用软锰矿(主要成分为MnO2)制备Mn(H2PO4)2•2H2O。常用稀硫酸酸浸软锰矿,同时通入SO2,此时发生反应的离子方程式为
Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入2molSO2和1molO2,在一定条件下发生反应2SO2(g)+O2(g)
| 时间/min | 4 | 8 | 12 | 18 | 25 |
| n(O2)/mol | 0.70 | 0.50 | 0.40 | 0.32 | 0.32 |
| A.v(SO2)=2v(O2) | B.容器内气体的平均摩尔质量不再发生变化 |
| C.SO2和O2的浓度之比为2:1 | D.SO3的百分含量不再发生变化 |
(4)0~8min内,用SO3表示该反应的平均速率为
(5)若起始时容器内压强为p0MPa,则平衡时,容器内压强约为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
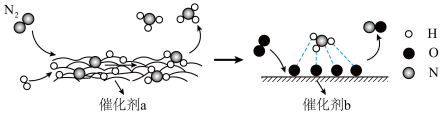
 在反应过程中作催化剂
在反应过程中作催化剂



