解答题-原理综合题 适中0.65 引用3 组卷252
哈伯发明用氮气和氢气合成氨的方法,获得了1918年诺贝尔化学奖。其原理为
 ,
,
________ (填“>”“<”或“=”)0。
(1)下列关于工业合成氨的说法不正确的是__________ (填标号)。
A.因为 ,所以该反应一定能自发进行
,所以该反应一定能自发进行
B.采用高压是为了增大反应速率,但会使反应物的转化率降低
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂增大反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是________ (填标号)。
a.容器内 、
、 、
、 的浓度之比为1∶3∶2
的浓度之比为1∶3∶2
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如图:
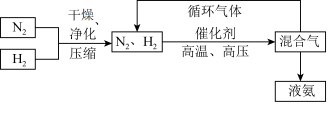
请用平衡移动原理解释在工艺流程中及时分离出氨气和将 分离后的原料气循环使用的原因
分离后的原料气循环使用的原因___________________ 。
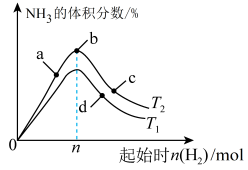
(4)某科研小组研究在其他条件不变的情况下,改变起始时氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示 的物质的量)。
的物质的量)。
①图中 和
和 的关系:
的关系:
________ (填“>”“<”或“=”) 。
。
②a、b、c、d四点所处的平衡状态中, 的转化率最高的是
的转化率最高的是__________ (填字母)。
(5)恒温下,向一个4L的密闭容器中充入5.2mol 和2mol
和2mol ,反应过程中对
,反应过程中对 的浓度进行测定,得到的数据如表所示:
的浓度进行测定,得到的数据如表所示:
①此条件下该反应的化学平衡常数
________ 。
②若维持容器容积不变,温度不变,向原平衡体系中加入 、
、 和
和 各4mol,化学平衡将向
各4mol,化学平衡将向_______ (填“正”或“逆”)反应方向移动。
(6)已知:





写出氨气催化氧化生成NO和水蒸气的热化学方程式________________ 。
(1)下列关于工业合成氨的说法不正确的是
A.因为
B.采用高压是为了增大反应速率,但会使反应物的转化率降低
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂增大反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是
a.容器内
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如图:

请用平衡移动原理解释在工艺流程中及时分离出氨气和将
(4)某科研小组研究在其他条件不变的情况下,改变起始时氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示
①图中
②a、b、c、d四点所处的平衡状态中,

(5)恒温下,向一个4L的密闭容器中充入5.2mol
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②若维持容器容积不变,温度不变,向原平衡体系中加入
(6)已知:
写出氨气催化氧化生成NO和水蒸气的热化学方程式
19-20高二·全国·课时练习
类题推荐
工业合成氨是人类科学技术的一项重大突破。其合成原理为:


(1)下列关于工业合成氨的说法正确的是___________。
(2)一定温度下,在密闭容器中充入 和
和 并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的
并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的 ,则
,则 的转化率为
的转化率为___________ 。
(3)工业上合成氨的部分工艺流程如图:
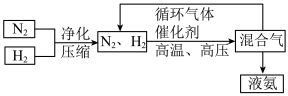
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因___________ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响,实验结果如图所示(图中T表示温度)。则:
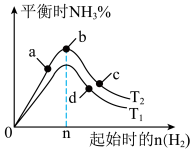
图象中 和
和 的关系是:
的关系是:
___________  (填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物
(填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是___________ (填字母)。
(5)恒温下,往一个 的密闭容器中充入
的密闭容器中充入 和
和 ,反应过程中对
,反应过程中对 的浓度进行检测,得到的数据如表所示:
的浓度进行检测,得到的数据如表所示:
此条件下该反应的化学平衡常数
___________ ;若维持容器体积不变,温度不变,往原平衡体系中加入 、
、 和
和 各
各 ,化学平衡将向
,化学平衡将向___________ 反应方向移动(填“正”或“逆”)。
(1)下列关于工业合成氨的说法正确的是___________。
| A.因为 |
| B.工业合成氨的反应是熵减小的放热反应,在常温时可自发进行 |
| C.合成氨反应选择在400~500℃进行的重要原因是此温度下氨的产率最高 |
| D.生产中在考虑动力和设备材料承受能力的前提下,压强越大越好 |
(2)一定温度下,在密闭容器中充入
(3)工业上合成氨的部分工艺流程如图:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响,实验结果如图所示(图中T表示温度)。则:

图象中
(5)恒温下,往一个
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示:(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)

(1)由图可知,决定反应速率的一步是_______ 。(填a、b、c……)
(2)下列关于工业合成氨的说法正确的是_______。
(3)请用平衡移动原理来解释在合成氨中及时分离出氨的原因_______ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示 物质的量,
物质的量, %表示
%表示 的百分含量)。
的百分含量)。
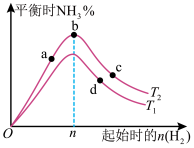
①图像中 和
和 的关系是:
的关系是:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是_______ (填字母)。
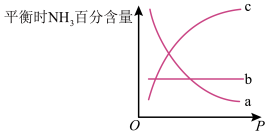
(5)其他条件不变,表示平衡时氨的百分含量随压强变化关系的曲线为_______ (填字母编号)。
(6)某温度下,向一个 的密闭容器中充入
的密闭容器中充入 和
和 ,反应过程中对
,反应过程中对 的浓度进行检测,得到的数据如下表所示:
的浓度进行检测,得到的数据如下表所示:
此条件下该反应的化学平衡常数
_______ 。
(7)氨氧化法是工业生产中制取硝酸的主要途径。
已知:





写出氨气催化氧化生成 和水蒸气的热化学方程式
和水蒸气的热化学方程式_______ 。

(1)由图可知,决定反应速率的一步是
(2)下列关于工业合成氨的说法正确的是_______。
| A.因为 |
| B.因为 |
| C.在高温下进行是为了提高反应物的平衡转化率 |
| D.使用催化剂不仅可以加快反应速率还可以降低反应所需的温度 |
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示

①图像中
②a、b、c、d四点所处的平衡状态中,反应物
(5)其他条件不变,表示平衡时氨的百分含量随压强变化关系的曲线为

(6)某温度下,向一个
| 时间 | 5 | 10 | 15 | 20 | 25 | 30 |
| 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
(7)氨氧化法是工业生产中制取硝酸的主要途径。
已知:
写出氨气催化氧化生成
合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氨气和氢气反应合成氨,实现了人工固氮,化学方程式为 。
。
(1)合成氨在农业和国防中有很重要的意义,在实际工业生产中常采用下列措施,可以用勒夏特列原理解释的是_______(选填字母代号)。
(2)某科研小组研究:在其他条件不变的情况下,改变氢气起始的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示 的起始物质的量)。
的起始物质的量)。
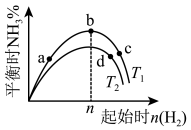
①图象中 和
和 ,的关系是
,的关系是
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是_______ (填字母代号)。
(3)恒温下,向一个4L的密闭容器中充入 和
和 ,反应过程中对
,反应过程中对 的浓度进行检测,得到的数据如下表所示:
的浓度进行检测,得到的数据如下表所示:
①此条件下该反应的化学平衡常数表达式为_______ ,若维持容器容积不变,温度不变,往原平衡体系中加入 和
和 各
各 ,化学平衡将向
,化学平衡将向_______ (填“正”或“逆”)反应方向移动;
②平衡时氮气的转化率为_______ ,反应放出的热量为_______  。
。
③研究表明,合成氨的速率与相关物质的浓度关系为 ,k为速率常数.以下说法正确的是
,k为速率常数.以下说法正确的是_______ (填字母)。
A.升高温度,k值增大
B.若容器内混合气体的密度不变,则反应达到平衡状态
C.将原容器中的 及时分离出来可使v增大
及时分离出来可使v增大
D.合成氨达到平衡后,增大 可使正反应速率在达到新平衡的过程中始终增大
可使正反应速率在达到新平衡的过程中始终增大
(1)合成氨在农业和国防中有很重要的意义,在实际工业生产中常采用下列措施,可以用勒夏特列原理解释的是_______(选填字母代号)。
| A.用铁触媒加快化学反应速率 |
| B.采用较高压强 |
| C.采用较高温度 |
| D.将生成的氨及时从体系中分离出来 |

①图象中
②a、b、c、d四点所处的平衡状态中,反应物
(3)恒温下,向一个4L的密闭容器中充入
| 时间 | 5 | 10 | 15 | 20 | 25 | 30 |
| 0.08 | 0.14 | 0.18 | 0.2 | 0.2 | 0.2 |
①此条件下该反应的化学平衡常数表达式为
②平衡时氮气的转化率为
③研究表明,合成氨的速率与相关物质的浓度关系为
A.升高温度,k值增大
B.若容器内混合气体的密度不变,则反应达到平衡状态
C.将原容器中的
D.合成氨达到平衡后,增大
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


