解答题-工业流程题 适中0.65 引用2 组卷133
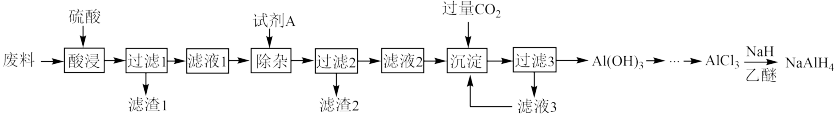
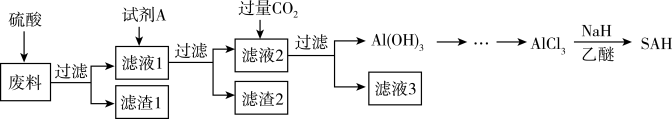
四氢铝钠(NaAlH4)是有机合成的重要还原剂。以铝合金厂的废边脚料为原料(主要成分为 Al,含有少量 Al2O3、Fe2O3、MgO 和 SiO2等杂质)制备 NaAlH4的工艺流程如图:
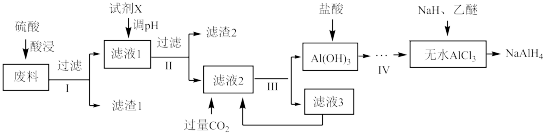
已知:NaH、NaAlH4 遇水发生剧烈反应。回答下列问题:
(1)酸浸时:
① H2SO4与 Al 反应的离子方程式为______ 。
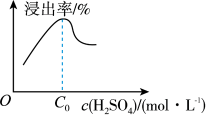
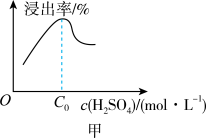
② 相同条件下,铝元素浸出率与 c(H2SO4)的关系如图所示。当 c(H2SO4)大于 a mol·L-1时,浸出率降低的原因可能是______ 。

(2)“调 pH”所加入的试剂 X 为______ (选填序号)。
A.H2SO4 B.NaOH C.NH3·H2O D.Na2CO3
(3)滤渣 1 的主要成分为______ (填化学式)。
(4)滤液 2 中,通入过量 CO2反应生成 Al(OH)3的离子方程式为______ 。
(5)AlCl3制得 NaAlH4反应的化学方程式为______ ,该反应体系要保证干燥,其目的是______ 。

已知:NaH、NaAlH4 遇水发生剧烈反应。回答下列问题:
(1)酸浸时:
① H2SO4与 Al 反应的离子方程式为
② 相同条件下,铝元素浸出率与 c(H2SO4)的关系如图所示。当 c(H2SO4)大于 a mol·L-1时,浸出率降低的原因可能是

(2)“调 pH”所加入的试剂 X 为
A.H2SO4 B.NaOH C.NH3·H2O D.Na2CO3
(3)滤渣 1 的主要成分为
(4)滤液 2 中,通入过量 CO2反应生成 Al(OH)3的离子方程式为
(5)AlCl3制得 NaAlH4反应的化学方程式为
19-20高三·福建泉州·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网