解答题-原理综合题 较难0.4 引用1 组卷245
合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意图如下:
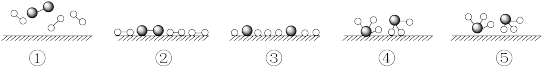
下列说法正确的是_____ (填标号)。
a.①表示N2、H2分子中均是单键
b.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
c.③→④需要吸收能量
d.②→③需要吸收能量
(2)已知 ;
;
 ,请分析工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
,请分析工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是_____ 。
(3)对于反应 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。
哈伯选用的条件是 、
、 ,而非
,而非 、
、 ,可能的原因是
,可能的原因是_____ 。(提示:温度会影响催化剂的活性)
(4)一定温度下,向容积恒定的密闭容器中充入1mol氮气和3mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1mol氮气和3mol氢气,氮气的平衡转化率_____ (填“变大”“变小”或“不变”)。
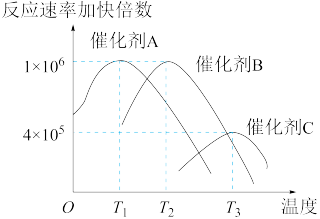
(5)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如下图所示(其他条件相同),则实际生产中适宜选择的催化剂是_____ (填“A"“B”或“C”)。
(6)下图是当反应器中按 投料后,在
投料后,在 、
、 、
、 反应达到平衡时,混合物中
反应达到平衡时,混合物中 的物质的量分数随总压强的变化曲线。
的物质的量分数随总压强的变化曲线。

①曲线a、b、c对应温度较高的是______ (填“a”或“b”或“c”)。
②列出b点平衡常数的计算式
_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;不要求计算结果)。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意图如下:

下列说法正确的是
a.①表示N2、H2分子中均是单键
b.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
c.③→④需要吸收能量
d.②→③需要吸收能量
(2)已知
(3)对于反应
| 温度/℃ | 压强/ | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
哈伯选用的条件是
(4)一定温度下,向容积恒定的密闭容器中充入1mol氮气和3mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1mol氮气和3mol氢气,氮气的平衡转化率
(5)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如下图所示(其他条件相同),则实际生产中适宜选择的催化剂是

(6)下图是当反应器中按

①曲线a、b、c对应温度较高的是
②列出b点平衡常数的计算式
20-21高二上·河南·阶段练习
类题推荐
合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g)⇌2NH3(g)的化学平衡常数表达式为_______ 。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是_______ 。
(3)对于反应N2(g)+3H2(g)⇌2NH3(g),在一定条件下氨的平衡含量如下表。
①该反应为_______ (填“吸热”或“放热”)反应。
②其他条件不变时,温度升高氨的平衡含量减小的原因是_______ (填字母序号)。
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
③哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是_______ 。
(4)一定温度下,在容积恒定的密闭容器中充入1mol氮气和3mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1mol氮气和3mol氢气,氮气的平衡转化率_______ (填“变大”“变小”或“不变”)。
(5)T℃时,在有催化剂的恒容密闭容器中充入N2和H2。下图为不同投料比[n(H2)/n(N2)]时某反应物X的平衡转化率变化曲线。

①反应物X是_______ (填“N2”或“H2”)。
②判断依据是_______ 。
(6)在其他条件相同时,下图为分别测定不同压强、不同温度下,N2的平衡转化率。L表示_______ ,其中X1_______ X2(填“>”或“<”)。

(1)反应N2(g)+3H2(g)⇌2NH3(g)的化学平衡常数表达式为
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① | N2(g)+O2(g)⇌2NO(g) | 5×10-31 |
| ② | N2(g)+3H2(g)⇌2NH3(g) | 4.1×106 |
(3)对于反应N2(g)+3H2(g)⇌2NH3(g),在一定条件下氨的平衡含量如下表。
| 温度/℃ | 压强/MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
①该反应为
②其他条件不变时,温度升高氨的平衡含量减小的原因是
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
③哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是
(4)一定温度下,在容积恒定的密闭容器中充入1mol氮气和3mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1mol氮气和3mol氢气,氮气的平衡转化率
(5)T℃时,在有催化剂的恒容密闭容器中充入N2和H2。下图为不同投料比[n(H2)/n(N2)]时某反应物X的平衡转化率变化曲线。

①反应物X是
②判断依据是
(6)在其他条件相同时,下图为分别测定不同压强、不同温度下,N2的平衡转化率。L表示

1909年哈伯(P•Haber)在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮,对人类的生存和发展有着重要意义,因此获得了诺贝尔奖。请回答:
(1)已知:①N2(g)+O2(g) 2NO(g) K(298K)=5×10-31
2NO(g) K(298K)=5×10-31
②N2(g)+3H2(g 2NH3(g) K(298K)=4×106
2NH3(g) K(298K)=4×106
分析以上数据,说明工业固氮选择反应②而非反应①的原因是_____ 。
(2)在铁触媒催化和30MPa下,合成氨反应平衡体系中氨的含量随温度的变化如下表所示。
目前工业实际生产一般选择500℃,其主要原因是_____ 。
(3)化学家GethardErtl证实了氮气与氢气在固体催化剂表面合成氨的过程,示意图如下:

下列说法正确的是_____
(4)在如图密闭容器中充入2molN2和6molH2,固定活塞保持容器体积为5L,在一定温度下催化反应,NH3的物质的量浓度随时间的变化如图所示。求:
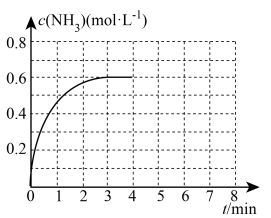
①前3min内平均反应速率:v(H2)=_____ 。
②平衡常数:K=_____ 。
③若在4min时,开启活塞保持恒温恒压,从容器中快速分离出2molNH3,在6min时,反应重新达到化学平衡,在下图1中画出4~8min内氨气的浓度变化曲线_____ 。
(5)我国科学家研制了Ti-H-Fe双温区催化剂(温差达100℃)合成氨,其主反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。
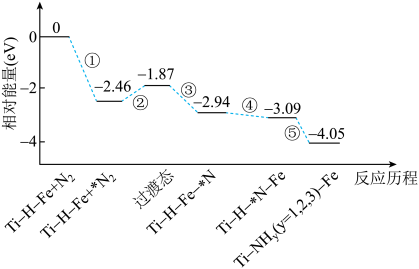
①②③所在Fe区域为_____ 温区(填:高或低),有利于_____ ;
④⑤所在Ti-H区域的温度有利于_____ 。
(1)已知:①N2(g)+O2(g)
②N2(g)+3H2(g
分析以上数据,说明工业固氮选择反应②而非反应①的原因是
(2)在铁触媒催化和30MPa下,合成氨反应平衡体系中氨的含量随温度的变化如下表所示。
| 温度/℃ | 200 | 300 | 400 | 500 |
| 氨的平衡含量 | 89.9% | 71.0% | 47.0% | 26.4% |
(3)化学家GethardErtl证实了氮气与氢气在固体催化剂表面合成氨的过程,示意图如下:

下列说法正确的是_____
| A.①→②吸附过程放热,有利于化学键的断裂,从而降低反应的活化能 |
| B.整个反应过程中,能量状态最低的是⑤处 |
| C.适时从反应体系中分离出氨气,有利于提高氨的解吸速率 |
| D.氮气和氢气以一定流速通过反应器,是否使用催化剂,对反应物的转化率无影响 |

①前3min内平均反应速率:v(H2)=
②平衡常数:K=
③若在4min时,开启活塞保持恒温恒压,从容器中快速分离出2molNH3,在6min时,反应重新达到化学平衡,在下图1中画出4~8min内氨气的浓度变化曲线
(5)我国科学家研制了Ti-H-Fe双温区催化剂(温差达100℃)合成氨,其主反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。

①②③所在Fe区域为
④⑤所在Ti-H区域的温度有利于
合成氨反应是目前最有效工业固氮的方法,解决数亿人口生存问题。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
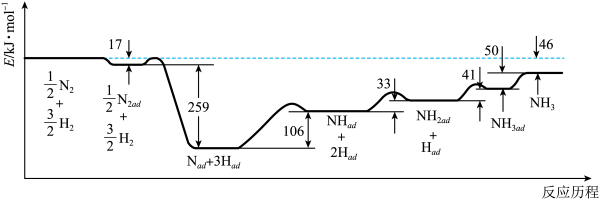
写出合成氨的热化学方程式:__________ ;该反应历程中最大能垒对应的化学方程式为:______ 。
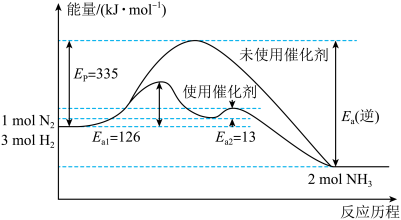
(2)如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=______ kJ·mol-1;使用催化剂之后,正反应的活化能为___ kJ·mol-1。
(3)恒温下,往一个4L的密闭容器中充入5.2 mol H2和2mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①求20 min内用H2表示的反应速率为__________ ;平衡时N2的转化率为________ ;
②若维持容器体积不变,温度不变,向原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向_______ 反应方向移动(填“正”或“逆”)。
(4)下列描述能说明该可逆反应达到化学平衡状态的有_________ (填序号)。
A 容器内的压强不变
B 容器内气体的密度不变
C 相同时间内有3molH—H键断裂,有6molN—H键形成
D 气体的平均相对分子质量不变
E
(5)充分反应后达到平衡。下列说法中正确的是____________ 。
A 保持体积不变,降温,平衡右移,逆反应速率增大
B 保持体积、温度不变,充入氦气后,正反应速率将增大
C 保持体积、温度不变,充入NH3气体,平衡向右移动
D 保持温度、压强不变,充入氦气后,平衡向左移动
(6)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则实际生产中适宜选择的催化剂是__ (填“A”“B”或“C”),理由是________ 。

(7)如图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
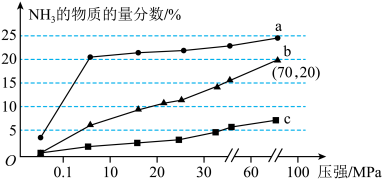
曲线a、b对应温度较高的是___ (填“a”或“b”)。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

写出合成氨的热化学方程式:
(2)如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=

(3)恒温下,往一个4L的密闭容器中充入5.2 mol H2和2mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①求20 min内用H2表示的反应速率为
②若维持容器体积不变,温度不变,向原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向
(4)下列描述能说明该可逆反应达到化学平衡状态的有
A 容器内的压强不变
B 容器内气体的密度不变
C 相同时间内有3molH—H键断裂,有6molN—H键形成
D 气体的平均相对分子质量不变
E
(5)充分反应后达到平衡。下列说法中正确的是
A 保持体积不变,降温,平衡右移,逆反应速率增大
B 保持体积、温度不变,充入氦气后,正反应速率将增大
C 保持体积、温度不变,充入NH3气体,平衡向右移动
D 保持温度、压强不变,充入氦气后,平衡向左移动
(6)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则实际生产中适宜选择的催化剂是

(7)如图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。

曲线a、b对应温度较高的是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


