解答题-实验探究题 适中0.65 引用1 组卷57
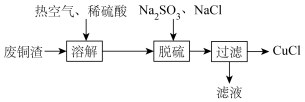
氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。写出该反应的离子方程式____________________________ 。
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000 g样品,放入盛有20 mL过量FeCl3 溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50 mL;
c.立即用0.2000 mol/LCe(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积;
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00 mL。已知:CuC1+Fe3+=Cu2++Fe2++Cl-、 Fe2++Ce4+=Fe3++Ce3+
①配制100 mL 0.2000 mol/L的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要______________ 。
②进行步骤c时若操作缓慢,则测得CuCl的纯度________ (填“偏大”、“偏小”或“无影响”)。
③通过计算确定该样品中CuCl的纯度_____________ (写出计算过程)。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。写出该反应的离子方程式
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000 g样品,放入盛有20 mL过量FeCl3 溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50 mL;
c.立即用0.2000 mol/LCe(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积;
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00 mL。已知:CuC1+Fe3+=Cu2++Fe2++Cl-、 Fe2++Ce4+=Fe3++Ce3+
①配制100 mL 0.2000 mol/L的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要
②进行步骤c时若操作缓慢,则测得CuCl的纯度
③通过计算确定该样品中CuCl的纯度
20-21高二上·江苏扬州·开学考试
类题推荐
Ⅰ.已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
(1)①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴___________ 溶液;
④用0.10 的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
(2)将样品配成250mL标准溶液,除小烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有___________ 。
(3)用___________ 盛装0.10 的盐酸标准液,向待测液滴加2-3滴
的盐酸标准液,向待测液滴加2-3滴___________ 指示剂。
(4)达到滴定终点时的标志为___________ 。
(5)烧碱样品的纯度为___________ 。
(6)用标准液滴定待测液,下列操作中导致中和滴定的测量值偏高的是___________ 。
a.锥形瓶用蒸馏水冲洗后,再用待测液润洗2~3次;
b.滴定开始时,滴定管尖嘴有气泡,滴定过程中气泡消失;
c.滴定前读数时仰视,滴定后读数平视;
d.摇动锥形瓶时,瓶中有少量液体溅出;
e.滴定时,锥形瓶中加入少量蒸馏水。
Ⅱ.常温下,向100 mL 的HA溶液中逐滴加入
的HA溶液中逐滴加入 的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
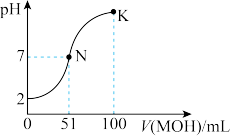
(7)由图中信息可知HA为___________ 酸(填“强”或“弱”),理由是___________ 。
(8)常温下一定浓度的MA稀溶液的 ,则a
,则a___________ (填“>”“<”或“=”)7,用离子方程式表示其原因:___________ ,此时,溶液中由水电离出的
___________ 。
(9)请写出K点所对应的溶液中离子浓度的大小关系:___________ 。
(10)K点对应的溶液中,
___________ (填“>”“<”或“=”) ;若此时溶液的pH=10,则
;若此时溶液的pH=10,则
___________  。
。
(1)①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴
④用0.10
| 滴定序号 | 待测液体积/(mL) | 所消耗盐酸标准液的体积/(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(3)用
(4)达到滴定终点时的标志为
(5)烧碱样品的纯度为
(6)用标准液滴定待测液,下列操作中导致中和滴定的测量值偏高的是
a.锥形瓶用蒸馏水冲洗后,再用待测液润洗2~3次;
b.滴定开始时,滴定管尖嘴有气泡,滴定过程中气泡消失;
c.滴定前读数时仰视,滴定后读数平视;
d.摇动锥形瓶时,瓶中有少量液体溅出;
e.滴定时,锥形瓶中加入少量蒸馏水。
Ⅱ.常温下,向100 mL

(7)由图中信息可知HA为
(8)常温下一定浓度的MA稀溶液的
(9)请写出K点所对应的溶液中离子浓度的大小关系:
(10)K点对应的溶液中,
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10 mol∙L−1的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
请回答:
(1)将样品配成250mL标准溶液,除小烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有_______ 。
(2)用_______ 盛装0.10 mol∙L−1的盐酸标准液,向待测液滴加2-3滴指示剂。
(3)达到滴定终点时的标志为_______ 。
(4)烧碱样品的纯度为_______ 。
(5)用标准液滴定待测液,下列操作中导致中和滴定的测量值偏高的是_______
a.锥形瓶用蒸馏水冲洗后,再用待测液润洗2~3次
b.滴定开始时,滴定管尖嘴有气泡,滴定过程中气泡消失
c.滴定前读数时仰视,滴定后读数平视
d.摇动锥形瓶时,瓶中有少量液体溅出
e.滴定时,锥形瓶中加入少量蒸馏水
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10 mol∙L−1的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
| 滴定序号 | 待测液体积/(mL) | 所消耗盐酸标准液的体积/(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(1)将样品配成250mL标准溶液,除小烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有
(2)用
(3)达到滴定终点时的标志为
(4)烧碱样品的纯度为
(5)用标准液滴定待测液,下列操作中导致中和滴定的测量值偏高的是
a.锥形瓶用蒸馏水冲洗后,再用待测液润洗2~3次
b.滴定开始时,滴定管尖嘴有气泡,滴定过程中气泡消失
c.滴定前读数时仰视,滴定后读数平视
d.摇动锥形瓶时,瓶中有少量液体溅出
e.滴定时,锥形瓶中加入少量蒸馏水
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网