解答题-实验探究题 适中0.65 引用1 组卷243
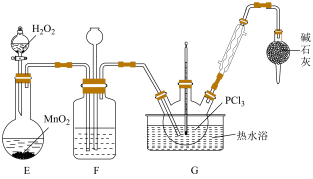
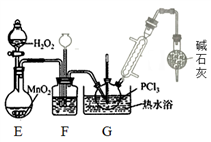
PCl3是一种重要的化工原料,实验室用如图装置制取PCl3。已知PCl3的熔点是-112℃,沸点是75.5℃,极易水解,受热易被氧气氧化。
请回答下列问题:
(1)实验开始前的操作依次是:①组装仪器,②_________ ,③加药品,④__________ ,⑤最后点燃酒精灯。
(2)导管a的作用是________ ;F装置的作用是__________ 。
(3)测定产品纯度,步骤如下:
i.称取5.00g产品,溶于水配成100mL溶液(发生反应:PCl3+3H2O=H3PO3+3HCl);
ii.取上述溶液25.00mL,加入20.00mL 0.4000mol/L碘水,充分氧化H3PO3;
iii.以淀粉溶液为指示剂,用0.0500mol/L硫代硫酸钠溶液滴定ii中所得溶液,发生的反应为I2+2 =
= +2I-,消耗硫代硫酸钠溶液12.00mL。
+2I-,消耗硫代硫酸钠溶液12.00mL。
①滴定终点时的现象是____________ 。
②该产品的纯度为____________ 。

请回答下列问题:
(1)实验开始前的操作依次是:①组装仪器,②
(2)导管a的作用是
(3)测定产品纯度,步骤如下:
i.称取5.00g产品,溶于水配成100mL溶液(发生反应:PCl3+3H2O=H3PO3+3HCl);
ii.取上述溶液25.00mL,加入20.00mL 0.4000mol/L碘水,充分氧化H3PO3;
iii.以淀粉溶液为指示剂,用0.0500mol/L硫代硫酸钠溶液滴定ii中所得溶液,发生的反应为I2+2
①滴定终点时的现象是
②该产品的纯度为
19-20高三·湖北荆州·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网