解答题-原理综合题 较难0.4 引用1 组卷161
NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g) 2CO(g)△H=-221.0kJ/mol
2CO(g)△H=-221.0kJ/mol
N2(g)+O2(g) 2NO(g)△H=+180.5kJ/mol
2NO(g)△H=+180.5kJ/mol
2NO(g)+2CO(g) 2CO2(g)+N2(g)△H=-746.0kJ/mol
2CO2(g)+N2(g)△H=-746.0kJ/mol
则用焦炭还原NO生成无污染气体的热化学方程式为____ 。该反应的平衡常数Kp=___ (写表达式)。
(2)用NR催化还原NOx也可以消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l)△H<0,相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
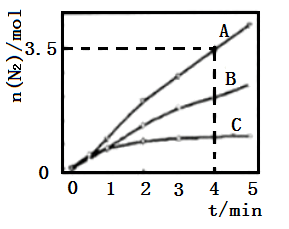
①在催化剂A的作用下,0~4min的v(NH3)=__________ 。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是______ ,理由是____________ 。
③下列说法正确的是_____ (填标号)。
a使用催化剂A达平衡时,△H值更大
b升高温度可使容器内气体颜色加深
c单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
(1)已知:2C(s)+O2(g)
N2(g)+O2(g)
2NO(g)+2CO(g)
则用焦炭还原NO生成无污染气体的热化学方程式为
(2)用NR催化还原NOx也可以消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l)△H<0,相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4min的v(NH3)=
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是
③下列说法正确的是
a使用催化剂A达平衡时,△H值更大
b升高温度可使容器内气体颜色加深
c单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
19-20高二上·黑龙江哈尔滨·阶段练习
类题推荐
NOx是造成大气污染的主要物质,工业上脱硝有多种方法。利用碳还原NO的反应为2NO(g)+C(s)  N2(g)+CO2(g)。回答下列问题:
N2(g)+CO2(g)。回答下列问题:
(1)该反应在常温下可以自发进行,则反应的△H_______ (填“>”“<”或“=”)0。
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol·L-1)随时间(s)的变化如下表所示。(已知:三个容器的反应温度分别为T甲=400℃、T乙=400℃、T丙=a℃)
丙容器的反应温度a_______ (填“>” “<”或“=”)400。
(3)已知:8NH3(g)+6NO2 (g) 7N2(g)+ 12H2O(l) △H< 0,相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化关系如图所示。
7N2(g)+ 12H2O(l) △H< 0,相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化关系如图所示。

①该反应活化能Ea(A)、Eb(B)、Ec(C)由小到大的顺序是_______ ,理由是_______ 。
②下列说法不正确的是_______ (填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N- H键与O- H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
(1)该反应在常温下可以自发进行,则反应的△H
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol·L-1)随时间(s)的变化如下表所示。(已知:三个容器的反应温度分别为T甲=400℃、T乙=400℃、T丙=a℃)
| 时间 | 0s | 10 s | 20 s | 30 s | 40 s |
| 甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| 乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0. 45 |
| 丙 | 2. 00 | 1.45 | 1. 00 | 1. 00 | 1. 00 |
(3)已知:8NH3(g)+6NO2 (g)

①该反应活化能Ea(A)、Eb(B)、Ec(C)由小到大的顺序是
②下列说法不正确的是
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N- H键与O- H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g)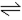 5N2(g) + 6H2O(l)
5N2(g) + 6H2O(l) 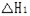
反应②:2NO(g) + O2(g)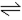 2NO2(g)
2NO2(g) 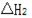 (
( 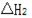 < 0且
< 0且 =2
=2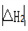 )
)
反应③:4NH3(g) + 6NO2(g)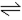 5N2(g)+ 3O2 + 6H2O(l)
5N2(g)+ 3O2 + 6H2O(l) 
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
(1)试推测反应③是______ 反应(填“吸热”或“放热”)。
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。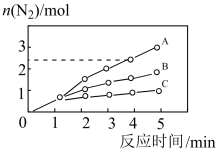
则:①计算0~4min时在A催化剂作用下,反应速率v(NO)=_______________
②下列说法正确的是:________________________
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO 和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_________ (填“是”或“不是”已知该温度下该反应的K约为147.3).达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和1.5mol的O2,则还要加入NO______ mol、O2_____ mol,达平衡时各物质的浓度才能跟前平衡的相等。
反应①:4NH3(g)+ 6NO(g)
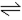 5N2(g) + 6H2O(l)
5N2(g) + 6H2O(l) 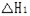
反应②:2NO(g) + O2(g)
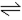 2NO2(g)
2NO2(g) 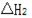 (
( 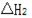 < 0且
< 0且 =2
=2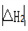 )
)反应③:4NH3(g) + 6NO2(g)
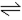 5N2(g)+ 3O2 + 6H2O(l)
5N2(g)+ 3O2 + 6H2O(l) 
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
| 温度/K | 反应① | 反应② | 已知: K2>K1>K2'>K1' |
| 298 | K1 | K2 | |
| 398 | K1' | K2' |
(1)试推测反应③是
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。

则:①计算0~4min时在A催化剂作用下,反应速率v(NO)=
②下列说法正确的是:
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO 和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



