解答题-工业流程题 较难0.4 引用1 组卷320
铁、钴、镍性质非常相似,被称为铁系元素。铁系元素在生产生活中有重要用途。
I. 氯化钴可用于化学反应催化剂,油漆催干剂等。用金属钴板(含少量Fe、Ni)制备氯化钴流程如下:
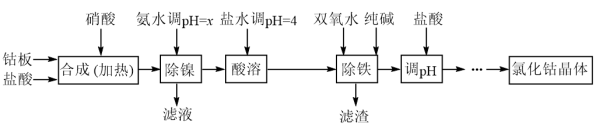
已知:①钴与盐酸反应极慢,需加入催化剂硝酸才能进行实际生产。
②有关钴、镍和铁化合物的性质见下表:
(1)实验室测溶液pH要用到的玻璃仪器有__________ 。
(2)“除镍”步骤中,NH3•H2O用量对残留Ni2+含量的影响见表:从表中可知x=_________ 时,除镍效果最好。
(3)“除铁”步骤中加入纯碱的作用是(利用水解平衡原理并结合必要的文字作答)__________________________ 。
(4)加盐酸调pH的目的是______________________ 。
II. 当代技术利用铁的氧化物循环裂解水制氢气的过程如下图所示。
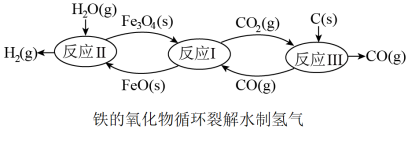
(5)已知:在20MPa、800℃下
Fe3O4(s) + CO(g)=3FeO(s) + CO2(g) ΔH1= +19.3 kJ·mol-1
3FeO(s) + H2O(g)=Fe3O4(s) + H2(g) ΔH2= -57.2 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH3= +172.4 kJ·mol-1
则该条件下,铁氧化物循环裂解水制氢气总反应的热化学方程式是__________ 。
III. 我国镍氢电池居世界先进水平。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为:LaNi5H6+6NiO(OH) LaNi5+6Ni(OH)2。
LaNi5+6Ni(OH)2。
(6)则该电池放电时负极反应式为:____________________ 。
(7)用镍氢电池做电源,在铁件的表面镀铜防止铁被腐蚀。装置示意图如下。

若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为4.48 g,则电镀时电路中通过的电子的物质的量为_______ 。
I. 氯化钴可用于化学反应催化剂,油漆催干剂等。用金属钴板(含少量Fe、Ni)制备氯化钴流程如下:

已知:①钴与盐酸反应极慢,需加入催化剂硝酸才能进行实际生产。
②有关钴、镍和铁化合物的性质见下表:
| 化学式 | 沉淀完全时的pH | 钴镍性质 |
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Ni+ 2HCl=NiCl2+H2↑ Co2++2H2O⇌ Ni2++ 6NH3•H2O=[Ni |
| Fe(OH)2 | 9.6 | |
| Fe(OH)3 | 3.7 |
(1)实验室测溶液pH要用到的玻璃仪器有
(2)“除镍”步骤中,NH3•H2O用量对残留Ni2+含量的影响见表:从表中可知x=
| 加氨水调pH | Ni2+含量 |
| 9 | 0.08% |
| 9.5 | 0.05% |
| 10 | 0.005% |
| 10.3 | 0.005% |
(3)“除铁”步骤中加入纯碱的作用是(利用水解平衡原理并结合必要的文字作答)
(4)加盐酸调pH的目的是
II. 当代技术利用铁的氧化物循环裂解水制氢气的过程如下图所示。

(5)已知:在20MPa、800℃下
Fe3O4(s) + CO(g)=3FeO(s) + CO2(g) ΔH1= +19.3 kJ·mol-1
3FeO(s) + H2O(g)=Fe3O4(s) + H2(g) ΔH2= -57.2 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH3= +172.4 kJ·mol-1
则该条件下,铁氧化物循环裂解水制氢气总反应的热化学方程式是
III. 我国镍氢电池居世界先进水平。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为:LaNi5H6+6NiO(OH)
(6)则该电池放电时负极反应式为:
(7)用镍氢电池做电源,在铁件的表面镀铜防止铁被腐蚀。装置示意图如下。

若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为4.48 g,则电镀时电路中通过的电子的物质的量为
20-21高三上·四川成都·开学考试
类题推荐
有关钴、镍和铁化合物的性质见下表:
氯化钴可用于化学反应催化剂,油漆催干剂,干湿指示剂,啤酒泡沫稳定剂,陶瓷着色剂,制造隐显墨水等。用金属钴板(含少量Fe、Ni)制备氯化钴的工艺流程如下:
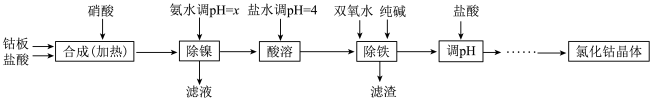
钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响,见下表:
从表中可知x=________ 时,除镍效果最好;
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀将有部分Co(OH)3生成,试写出反应的化学方程式________ ;
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________ ;
(4)“除铁”步骤中加入的纯碱作用是________ ;
(5)在“调pH"步骤中,加盐酸的作用是________ ;
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数为
Fe(OH)3+3H+的平衡常数为__________ 。
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3•H2O=Co(OH)2↓+2 NH4+ Ni+2HCl=NiCl2+H2↑ Co2++2H2O Ni2++6NH3•H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe(OH)3 | 3.7 |

钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响,见下表:
加NH3•H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀将有部分Co(OH)3生成,试写出反应的化学方程式
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是
(4)“除铁”步骤中加入的纯碱作用是
(5)在“调pH"步骤中,加盐酸的作用是
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O
 Fe(OH)3+3H+的平衡常数为
Fe(OH)3+3H+的平衡常数为 用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
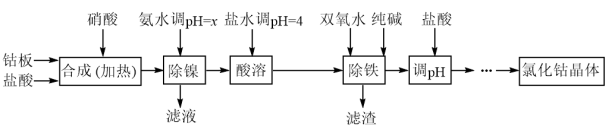
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______ 时,除镍效果最好。
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________ 。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________ 。
(4)“除铁”步骤中加入的纯碱作用是________________________________ 。
(5)在“调pH”步骤中,加盐酸的作用是______________________________ 。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数为
Fe(OH)3+3H+的平衡常数为_____________________ 。

注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
| 化学式 | 沉淀完全时的pH | 钴镍性质 |
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
| Fe(OH)2 | 9.6 | |
| Fe (OH)3 | 3.7 |
| 加NH3·H2O调pH | 收率/% | Ni2+含量/% |
| 9 | 98.1 | 0.08 |
| 9.5 | 98 | 0.05 |
| 10 | 97.6 | 0.005 |
| 10.3 | 94 | 0.005 |
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是
(4)“除铁”步骤中加入的纯碱作用是
(5)在“调pH”步骤中,加盐酸的作用是
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O
2030年全球新能源动力电池镍消费量将达到2020年全球镍产量的近40%。碱式碳酸镍[NiCO3·2Ni(OH)2·xH2O]在工业上可作为制备其他含镍化合物的原料。工业上由某含镍废渣精矿(主要成分为NiO、Fe2O3,CuO、SiO2)为原料制备碱式碳酸镍的流程如图1所示。
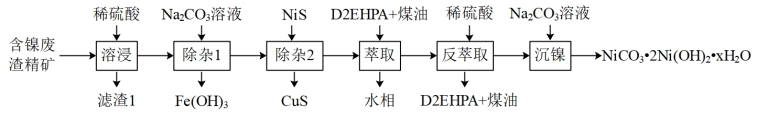
已知:①25°C时,相关离子开始沉淀和完全沉淀的pH如表所示。
②25°C时,Ksp(NiS)=1.0x10-27,Ksp(CuS)=8.0x10-35。
回答下列问题:
(1)滤渣I的主要成分为___________ (填化学式)。
(2)“除杂1”时应利用加入的Na2CO3溶液调节溶液的pH范围为___________ 。
(3)“除杂2”时发生反应的离子方程式为NiS(s)+Cu2+(aq) CuS(s)+Ni2+(aq)。25°C时,该反应的化学平衡常数为
CuS(s)+Ni2+(aq)。25°C时,该反应的化学平衡常数为___________ ;实验测得此工序中加入NiS的物质的量与“除杂1”所得溶液中Cu2+的物质的量之比、反应温度对“除杂2”所得滤渣中铜镍比的关系分别如图2和图3所示。

则最佳的加入NiS的物质的量与“除杂1"所得溶液中Cu2+的物质的量之比和反应温度分别为___________ 、___________ 。
(4)“萃取"和“反萃取"的最终目的是富集获得含有___________ (填化学式)的水溶液。
(5)“沉镍”时应控制温度为95°C,反应除生成NiCO3·2Ni(OH)2·xH2O外,还有一种无色气体生成。该气体为___________ 分子(填“极性"或“非极性")。
(6)碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池的工作原理为:Ni(OH)2+M NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为
NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___________ 。
(7)工业上,镍作阳极,电解0.1mol·L-1NiCl2溶液与一定量NH4Cl溶液组成的混合溶液,可得到高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电极上实际沉积的物质的量与理论析出量之比)及Ni的成粉率的影响如图4所示。
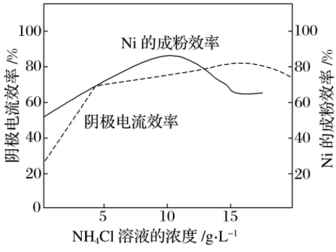
①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为___________ g·L-1。
②当NH4Cl浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,请解释其可能的原因是___________ 。

已知:①25°C时,相关离子开始沉淀和完全沉淀的pH如表所示。
| 离子 | Ni2+ | Fe3+ | Cu2+ |
| 开始沉淀时的pH | 6.4 | 2.2 | 4.4 |
| 完全沉淀时的pH | 8.4 | 3.5 | 6.7 |
回答下列问题:
(1)滤渣I的主要成分为
(2)“除杂1”时应利用加入的Na2CO3溶液调节溶液的pH范围为
(3)“除杂2”时发生反应的离子方程式为NiS(s)+Cu2+(aq)

则最佳的加入NiS的物质的量与“除杂1"所得溶液中Cu2+的物质的量之比和反应温度分别为
(4)“萃取"和“反萃取"的最终目的是富集获得含有
(5)“沉镍”时应控制温度为95°C,反应除生成NiCO3·2Ni(OH)2·xH2O外,还有一种无色气体生成。该气体为
(6)碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池的工作原理为:Ni(OH)2+M
(7)工业上,镍作阳极,电解0.1mol·L-1NiCl2溶液与一定量NH4Cl溶液组成的混合溶液,可得到高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电极上实际沉积的物质的量与理论析出量之比)及Ni的成粉率的影响如图4所示。

①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为
②当NH4Cl浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,请解释其可能的原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


