填空题 适中0.65 引用1 组卷32
一定条件下,H2O2在水溶液中发生分解反应:2H2O2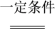 2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
(1)该反应__ (填“是”或者“不是”)氧化还原反应。
(2)该分解反应0~20min的平均反应速率v(H2O2)为__ mol/(L·min)。
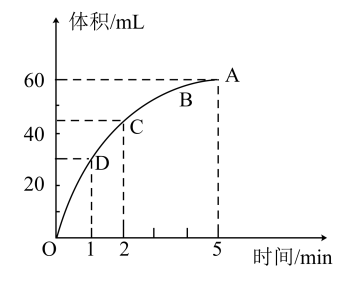
(3)加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示;反应放出 气体所需要的时间为
气体所需要的时间为__ ;A、B、C、D四点化学反应速率快慢的顺序为__ 。
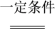 2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/(mol/L) | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(1)该反应
(2)该分解反应0~20min的平均反应速率v(H2O2)为
(3)加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示;反应放出

20-21高二上·四川广安·开学考试
类题推荐
一定条件下,H2O2在水溶液中发生分解反应:2H2O2 2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
① H2O2的分解反应________ 氧化还原反应(填“是”或“不是”).
②该分解反应0─20min的平均反应速率v(H2O2)为________ mol•L﹣1 min﹣1 .
③如果反应所用的H2O2溶液为100mL,则共产生O2________ g.
A.0.08 B.0.16 C.1.28 D.2.4.
 2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/mol•L﹣1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
① H2O2的分解反应
②该分解反应0─20min的平均反应速率v(H2O2)为
③如果反应所用的H2O2溶液为100mL,则共产生O2
A.0.08 B.0.16 C.1.28 D.2.4.
I、(1)普通锌锰干电池的结构如图所示。回答下列问题。

①电池中电解质溶液为________ 。
②负极反应式为______________________________________ 。
③放电时NH 向
向________ (填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是________ ,若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是________ (填序号)。
A.微热 B.加入适量氧化铜 C.加入少量硫酸铜溶液
D.加水 E.加入少量氢氧化钡溶液
II、一定条件下,H2O2在水溶液中发生分解反应:2H2O2 2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
(1)H2O2的分解反应________ 氧化还原反应(填“是”或“不是”)。
(2)该分解反应0~20 min的平均反应速率v(H2O2)为________ mol/(L·min)。
(3) 加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g/mL),在标准状况下放出气体的体积和时间的关系如图所示,反应放出 气体所需要的时间为
气体所需要的时间为________ ;A、B、C、D四点化学反应速率快慢的顺序为________ 。

(4)由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:③CO(g) + H2O (g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应: ④2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为________________

①电池中电解质溶液为
②负极反应式为
③放电时NH
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是
A.微热 B.加入适量氧化铜 C.加入少量硫酸铜溶液
D.加水 E.加入少量氢氧化钡溶液
II、一定条件下,H2O2在水溶液中发生分解反应:2H2O2
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/(mol/L) | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)该分解反应0~20 min的平均反应速率v(H2O2)为
(3) 加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g/mL),在标准状况下放出气体的体积和时间的关系如图所示,反应放出

(4)由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:③CO(g) + H2O (g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应: ④2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



