解答题-工业流程题 较难0.4 引用2 组卷173
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面,如图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2) 的流程。
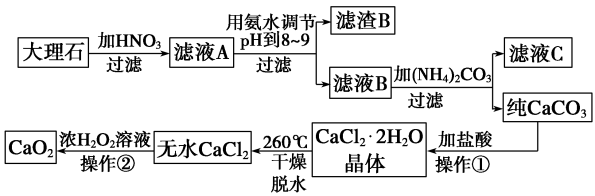
请回答下列问题:
(1)写出加硝酸后反应的离子方程式___________ 。
(2)操作①应包括的步骤是___________ 。
(3)用氨水调节pH至8~9的目的是___________ 。
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中 c( )
)___________ c( )(填“≥”、“≤”、“<”、“>”或“=”)。
)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出加氢氧化钠前该反应的化学方程式__________ ;用简要的文字解释用氢氧化钠调节pH至9~11的原因__________ 。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率________ 。

请回答下列问题:
(1)写出加硝酸后反应的离子方程式
(2)操作①应包括的步骤是
(3)用氨水调节pH至8~9的目的是
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中 c(
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出加氢氧化钠前该反应的化学方程式
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率
20-21高三上·上海宝山·开学考试
类题推荐
以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取Na2CrO4晶体的工艺流程如下:
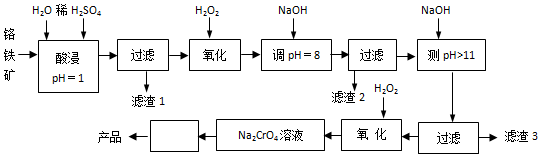
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下部分阳离子以氢氧化物形式沉淀时溶液pH如下:
(1)滤渣1主要成分是__________________ 。
(2)写出流程中第1次使用H2O2时,发生反应的离子方程式__________________ 。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?___________ 。
(4)写出第2次使用H2O2时,发生反应的离子方程式___________ 。
(5)流程图中从Na2CrO4溶液至产品中间“□”内的操作是__________ 、__________ 过滤、洗涤、干燥
(6)当溶液调pH=10时,则溶液中c(Mg2+) 为__________ 。【已知Ksp(Mg(OH)2)=5.6×10-12】
(7) 在酸性条件下转化为
在酸性条件下转化为 。工业上常用Fe2+处理酸性K2Cr2O7废水,先将
。工业上常用Fe2+处理酸性K2Cr2O7废水,先将 转化为Cr3+,该反应的离子方程式为
转化为Cr3+,该反应的离子方程式为_____________ ,再调节溶液的pH使金属离子生成沉淀而除去。

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下部分阳离子以氢氧化物形式沉淀时溶液pH如下:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | —— | —— |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
(1)滤渣1主要成分是
(2)写出流程中第1次使用H2O2时,发生反应的离子方程式
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?
(4)写出第2次使用H2O2时,发生反应的离子方程式
(5)流程图中从Na2CrO4溶液至产品中间“□”内的操作是
(6)当溶液调pH=10时,则溶液中c(Mg2+) 为
(7)
过氧化钙难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.某小组用含有少量氧化亚铁和氧化铁杂质的大理石制取过氧化钙的流程如下:
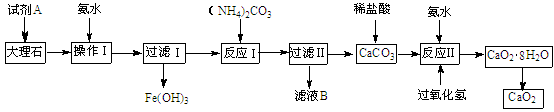
请回答下列问题:
(1)操作I的目的是调节溶液的pH,使铁元素完全沉淀,则试剂A最好选用______ 。
a.盐酸 b.硝酸 c.盐酸和过氧化氢 d.硫酸
(2)检验操作I中铁元素已沉淀完全的操作是_____ 。
(3)滤液B主要成分的化学式是_____ 。
(4)反应Ⅱ是放热反应。保持H2O2物质的量一定,当H2O2浓度小于20%时,CaO2的产率随H2O2浓度的增大而增大;但浓度大于20%后,CaO2产率反而下降。试分析CaO2产率下降的可能原因是______ 。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量:
步骤1:准确称取0.3900g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入10 mL蒸馏水和20 mL磷酸(1:3),振荡使样品完全溶解;
步骤3:用0.1000 mol·L-1 KMnO4标准溶液滴定至终点,记录数据;
步骤4:平行测定4次(数据记录见下表),计算试样中CaO2的质量分数。
已知:上述实验过程中反应关系为:CaO2~H2O2,5H2O2~2KMnO4
请回答下列问题:
(5)步骤3判断滴定达到终点的现象是_____ ;
(6)由表中数据可知,该样品中CaO2含量为___ %。若实验时刚洗净的滴定管未用KMnO4标准溶液润洗,则CaO2的质量分数测定结果___ (填“偏高”、“偏低”或“无影响”)。
Ⅰ.某小组用含有少量氧化亚铁和氧化铁杂质的大理石制取过氧化钙的流程如下:

请回答下列问题:
(1)操作I的目的是调节溶液的pH,使铁元素完全沉淀,则试剂A最好选用
a.盐酸 b.硝酸 c.盐酸和过氧化氢 d.硫酸
(2)检验操作I中铁元素已沉淀完全的操作是
(3)滤液B主要成分的化学式是
(4)反应Ⅱ是放热反应。保持H2O2物质的量一定,当H2O2浓度小于20%时,CaO2的产率随H2O2浓度的增大而增大;但浓度大于20%后,CaO2产率反而下降。试分析CaO2产率下降的可能原因是
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量:
步骤1:准确称取0.3900g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入10 mL蒸馏水和20 mL磷酸(1:3),振荡使样品完全溶解;
步骤3:用0.1000 mol·L-1 KMnO4标准溶液滴定至终点,记录数据;
步骤4:平行测定4次(数据记录见下表),计算试样中CaO2的质量分数。
| 实验 | 1 | 2 | 3 | 4 |
| V(KMnO4) /mL | 19.50 | 21.50 | 19.48 | 19.52 |
已知:上述实验过程中反应关系为:CaO2~H2O2,5H2O2~2KMnO4
请回答下列问题:
(5)步骤3判断滴定达到终点的现象是
(6)由表中数据可知,该样品中CaO2含量为
工业上常用辉铜矿(主要成分为Cu2S,含有Fe2O3、CaO、SiO2等杂质)制备重要催化剂CuCl。工艺如下:

已知:①CuCl为难溶于水的白色固体
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
请回答下列问题:
(1)“浸取”过程中Cu2S转化为可溶性铜盐的离子方程式为:___________ 。
(2)“浸取“是该工艺的第一步,提高浸出率可提高最终产品产率。工程师研究发现单独加入FeCl3溶液时Cu2+浸出率很低,但同时加入FeCl3溶液和H2O2时可提高Cu2+浸出率,写出H2O2与Fe2+反应的离子方程式___________ 。进一步研究发现,加入H2O2后随温度升高,一定时间后Cu2+浸出率随温度变化的曲线如图。请分析温度高于85℃,Cu2+浸出率下降的原因___________ 。

(3)已知Ksp(CaF2)=4.0×10−11经测定“浸出液”中Ca2+浓度为4.0×10−3mol·L−1,加入NaF除去溶液中Ca2+,当溶液中c(F-)=1.0×10−3mol·L−1时,溶液中Ca2+浓度为___________ mg/L。
(4)“除铁”过程包括氧化Fe2+、加入CuO调节pH等过程,为达到“除铁”目的需调节溶液pH范围为___________ 。
(5)“还原”过程中反应的离子方程式为:___________ 。
(6)通过“操作X”为过滤 ,___________ ,___________ (填操作名称),最终得到CuCl产品。

已知:①CuCl为难溶于水的白色固体
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Cu2+ | 4.4 | 6.4 |
(1)“浸取”过程中Cu2S转化为可溶性铜盐的离子方程式为:
(2)“浸取“是该工艺的第一步,提高浸出率可提高最终产品产率。工程师研究发现单独加入FeCl3溶液时Cu2+浸出率很低,但同时加入FeCl3溶液和H2O2时可提高Cu2+浸出率,写出H2O2与Fe2+反应的离子方程式

(3)已知Ksp(CaF2)=4.0×10−11经测定“浸出液”中Ca2+浓度为4.0×10−3mol·L−1,加入NaF除去溶液中Ca2+,当溶液中c(F-)=1.0×10−3mol·L−1时,溶液中Ca2+浓度为
(4)“除铁”过程包括氧化Fe2+、加入CuO调节pH等过程,为达到“除铁”目的需调节溶液pH范围为
(5)“还原”过程中反应的离子方程式为:
(6)通过“操作X”为过滤 ,
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


