解答题-原理综合题 适中0.65 引用1 组卷100
二氧化碳甲烷化技术被认为是二氧化碳循环再利用最有效的技术之一。回答下列问题:
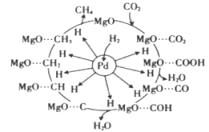
(1)Pd-MgO/SiO2界面上甲烷化的过程如图:
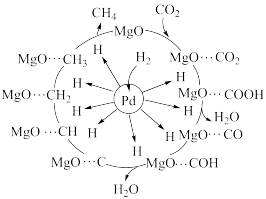
下列说法正确的是______ (填标号)。
A.整个循环过程中镁的价态不断发生改变 B.循环中Pd、MgO、SiO2均未参与反应
C.氢分子在Pd表面被吸附并解离为氢原子 D.总反应为4H2+CO2=CH4+2H2O
(2)已知CO2甲烷化过程中包含下列反应:
I.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+42.1kJ·mol-1K1
CO(g)+H2O(g) △H1=+42.1kJ·mol-1K1
II.CO(g)+3H2(g) CH4(g)+H2O(g) △H2=-206.5kJ·mol-1K2
CH4(g)+H2O(g) △H2=-206.5kJ·mol-1K2
保持压强不变,在0.1MPa下,起始时充入3molH2、1molCO2,不同温度下催化甲烷化时,平衡时物质(H2O未列出)的物质的量分数与温度的关系如图所示:
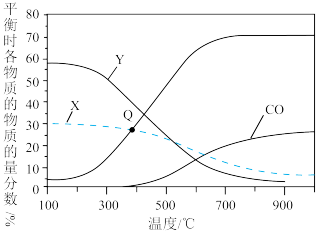
①总反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=_____ kJ·mol-1;其平衡常数K=______ (用含K1、K2的代数式表示)。
②图中X为CO2,则Y表示的物质是_________ (填化学式)。
③温度超过400℃时,升高温度,CO的物质的量分数不断增大,这是因为________ 。
④图中Q点时(对应温度下,可认为体系中不含CO),CH4的压强为_______ MPa,该温度下,甲烷化总反应的平衡常数为__________ (用分压表示,分压=总压×物质的量分数)(MPa)2。
(1)Pd-MgO/SiO2界面上甲烷化的过程如图:

下列说法正确的是
A.整个循环过程中镁的价态不断发生改变 B.循环中Pd、MgO、SiO2均未参与反应
C.氢分子在Pd表面被吸附并解离为氢原子 D.总反应为4H2+CO2=CH4+2H2O
(2)已知CO2甲烷化过程中包含下列反应:
I.CO2(g)+H2(g)
II.CO(g)+3H2(g)
保持压强不变,在0.1MPa下,起始时充入3molH2、1molCO2,不同温度下催化甲烷化时,平衡时物质(H2O未列出)的物质的量分数与温度的关系如图所示:

①总反应CO2(g)+4H2(g)
②图中X为CO2,则Y表示的物质是
③温度超过400℃时,升高温度,CO的物质的量分数不断增大,这是因为
④图中Q点时(对应温度下,可认为体系中不含CO),CH4的压强为
19-20高三·湖南·阶段练习
类题推荐
二氧化碳、甲烷等是主要的温室气体。研发二氧化碳和甲烷的利用技术对治理生态环境具有重要意义。
已知:常温常压下,一些物质的燃烧热如表所示。
回答下列问题:
(1)在催化剂作用下,甲烷的催化重整是制备合成气的重要方法,写出CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式:______ 。
(2)在恒温恒容密闭容器中,通入一定量的CH4、CO2发生催化重整反应。
①下列能说明该反应达到化学平衡状态的是______ (填标号)。
A.混合气体的平均相对分子质量不再变化 B.v正(CH4)=2v逆(CO)
C.CO与H2浓度的比值不再变化 D.容器内混合气体的密度不再变化
②当投料比 =1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。由图可知:压强p1
=1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。由图可知:压强p1______ 2MPa(填“>”、“<”或“=”);当温度为T3、初始压强为2MPa时,a点的v逆______ v正(填“>”、“<”或“=”)。起始时向1 L恒容容器中加入2 mol CH4和2 mol CO2,在温度为T6、初始压强为2 MPa条件下反应,用压强表示该反应的平衡常数Kp=______ (分压=总压×物质的量分数)。

(3)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→ +(2-
+(2- )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如 +2H2O→CO2+(2+
+2H2O→CO2+(2+ )H2。反应过程和能量变化残图如图:
)H2。反应过程和能量变化残图如图:
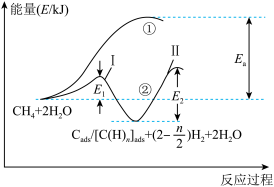
判断过程______ (填序号)加入了催化剂,原因是______ 。控制整个过程②反应速率的是第Ⅱ步,其原因为______ 。
已知:常温常压下,一些物质的燃烧热如表所示。
| 物质 | CH4(g) | H2(g) | CO(g) |
| 燃烧热(△H)/(kJ•mol-1) | -890.3 | -285.8 | -283.0 |
(1)在催化剂作用下,甲烷的催化重整是制备合成气的重要方法,写出CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式:
(2)在恒温恒容密闭容器中,通入一定量的CH4、CO2发生催化重整反应。
①下列能说明该反应达到化学平衡状态的是
A.混合气体的平均相对分子质量不再变化 B.v正(CH4)=2v逆(CO)
C.CO与H2浓度的比值不再变化 D.容器内混合气体的密度不再变化
②当投料比

(3)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→

判断过程
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网