解答题-实验探究题 适中0.65 引用3 组卷235
某兴趣小组通过皂化反应制作肥皂,实验流程图如下:

请回答:
(1)步骤I加入乙醇的目的是_________________________________ 。
(2)验证步骤II中反应已完全的操作是____________________________ 。
(3)步骤III加入60 mL热饱和食盐水,充分搅拌,冷却后即有脂肪酸钠固体析出,若直接用冷的饱和食盐水,则所得皂基容易吸水糊化,使用饱和食盐水的目的是________________ ;必须使用热饱和食盐水的原因是__________________ 。
(4)向皂化尾液中滴入新制Cu(OH)2,振荡,溶液呈绛蓝色,该反应的化学方程式为__________________________________________________ 。
(5)①查阅资料,一种从皂化尾液中分离提纯甘油(丙三醇)的工艺:先向皂化尾液中加入3倍体积的正丁醇;随着正丁醇的加入,皂化尾液中的盐分会结晶析出,液相分为上层有机相和下层水相;上层有机相经过精馏(一种蒸馏方法),回收正丁醇,同时除去水,并得到高纯度甘油;下层水相过滤,滤液回流至萃取塔内再处理,结晶的氯化钠洗涤回收。
下列说法正确的是__________ 。
A.正丁醇与水可以任意比例互溶 B.氯化钠在正丁醇中溶解度小
C.分层后甘油全在有机相,水相中没有残留 D.正丁醇的沸点低于甘油
②小组采用下图装置模拟分离提纯甘油(夹持装置和加热装置已略去,毛细管的作用是防止暴沸)。

请选择正确的操作并按序排列:装配好蒸馏装置→检查装置的气密性→向蒸馏烧瓶加入适量皂化尾液→打开真空泵→接通冷凝水→给蒸馏烧瓶加热→_______ →________ →________ →_______ →拆除装置。
a.收集甘油,至温度计读数开始增大时;b.收集正丁醇与水的混合物,至温度计读数开始增大时;c.等体系内外压力平衡后关闭真空泵;d.无馏出物后,关闭冷凝水;e.移去热源。

请回答:
(1)步骤I加入乙醇的目的是
(2)验证步骤II中反应已完全的操作是
(3)步骤III加入60 mL热饱和食盐水,充分搅拌,冷却后即有脂肪酸钠固体析出,若直接用冷的饱和食盐水,则所得皂基容易吸水糊化,使用饱和食盐水的目的是
(4)向皂化尾液中滴入新制Cu(OH)2,振荡,溶液呈绛蓝色,该反应的化学方程式为
(5)①查阅资料,一种从皂化尾液中分离提纯甘油(丙三醇)的工艺:先向皂化尾液中加入3倍体积的正丁醇;随着正丁醇的加入,皂化尾液中的盐分会结晶析出,液相分为上层有机相和下层水相;上层有机相经过精馏(一种蒸馏方法),回收正丁醇,同时除去水,并得到高纯度甘油;下层水相过滤,滤液回流至萃取塔内再处理,结晶的氯化钠洗涤回收。
下列说法正确的是
A.正丁醇与水可以任意比例互溶 B.氯化钠在正丁醇中溶解度小
C.分层后甘油全在有机相,水相中没有残留 D.正丁醇的沸点低于甘油
②小组采用下图装置模拟分离提纯甘油(夹持装置和加热装置已略去,毛细管的作用是防止暴沸)。

请选择正确的操作并按序排列:装配好蒸馏装置→检查装置的气密性→向蒸馏烧瓶加入适量皂化尾液→打开真空泵→接通冷凝水→给蒸馏烧瓶加热→
a.收集甘油,至温度计读数开始增大时;b.收集正丁醇与水的混合物,至温度计读数开始增大时;c.等体系内外压力平衡后关闭真空泵;d.无馏出物后,关闭冷凝水;e.移去热源。
20-21高三上·浙江·阶段练习
类题推荐
乙酰乙酸乙酯是重要的有机合成原料,实验室制备乙酰乙酸乙酯的反应原理为: 。甲是制备装置(烧瓶中物质充分反应后再滴加乙酸溶液)、乙是部分分离装置,流程图是分离步骤:
。甲是制备装置(烧瓶中物质充分反应后再滴加乙酸溶液)、乙是部分分离装置,流程图是分离步骤:


已知:①几种物质的部分性质:
②10mL乙酸乙酯粗品中含乙酸乙酯8.8g和少量乙醇
③ 亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。
亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。
请回答下列有关问题:
(1)①钠颗粒可以经下列步骤得到:
烧瓶 钠熔化
钠熔化 小米状钠珠
小米状钠珠
下表是钠和一些常用有机液体的物理性质:
三种有机液体中熔化钠的最佳试剂是_______
②制备反应需要加热才能发生,装置甲的最适合的加热方式_______
A.酒精灯直接加热 B.垫石棉网用酒精灯加热 C.水浴 D.油浴
(2)关于装置甲及流程中的部分步骤,下列说法不正确的是_______。
(3)滴加50%乙酸至恰好呈弱酸性的原因是:_______ 。
(4)操作④是一个系列过程,先水浴加热蒸出乙酸乙酯,剩余液再经下列步骤得到产品,请选择合理操作并排序:剩余液加入装置乙的烧瓶中→e→____→____→____→i→____→d→____→____→拆除装置并保存产品。_______ 。
a.开抽气泵 b.关闭抽气泵 c.调小毛细管空气流量 d.调大毛细管空气流量 e.开启冷凝水 f.关闭冷凝水 g.缓慢加热 h.停止加热 i.收集馏分
(5)上述实验中乙酰乙酸乙酯的产率为_______ (保留两位有效数字)。


已知:①几种物质的部分性质:
| 物质 | 沸点/℃ | 相对分子质量 | 水中溶解性 |
| 乙酸乙酯 | 77.2 | 88 | 难溶 |
| 乙酰乙酸乙酯 | 181(温度超过95℃,易分解) | 130 | 微溶 |
| 乙酸 | 118 | 60 | 易容 |
③
请回答下列有关问题:
(1)①钠颗粒可以经下列步骤得到:
烧瓶
下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 二甲苯 | 四氯化碳 | |
| 密度 | 0.97 | 0.88 | 0.85 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | 13.3 | ﹣22.8 |
| 沸点(℃) | 881.4 | 80 | 138.4 | 76.8 |
②制备反应需要加热才能发生,装置甲的最适合的加热方式
A.酒精灯直接加热 B.垫石棉网用酒精灯加热 C.水浴 D.油浴
(2)关于装置甲及流程中的部分步骤,下列说法不正确的是_______。
| A.制备钠珠后,通过过滤分离钠珠和有机溶剂 |
| B.干燥管中的试剂一定不是干燥剂,因为滴加乙酸溶液也带入水,干燥无意义 |
| C.操作①与操作②相同,所加饱和氯化钠溶液和乙酸乙酯都是为了减小产品溶解,利于分层 |
| D.操作③包括分液和过滤,饱和 |
(4)操作④是一个系列过程,先水浴加热蒸出乙酸乙酯,剩余液再经下列步骤得到产品,请选择合理操作并排序:剩余液加入装置乙的烧瓶中→e→____→____→____→i→____→d→____→____→拆除装置并保存产品。
a.开抽气泵 b.关闭抽气泵 c.调小毛细管空气流量 d.调大毛细管空气流量 e.开启冷凝水 f.关闭冷凝水 g.缓慢加热 h.停止加热 i.收集馏分
(5)上述实验中乙酰乙酸乙酯的产率为
海洋是一座巨大的化学资源宝库,从海水中或海产品中提取多种化学物质。
I.试剂级 可用海盐(含泥沙、海藻、
可用海盐(含泥沙、海藻、 等杂质)为原料制备。制备流程如下:
等杂质)为原料制备。制备流程如下:
(1)
焙炒海盐的目的是___________ 。
(2)根据除杂原理、预期沉淀的离子,填写合适的试剂。
其中步骤2和步骤3是否可以颠倒,请给出解释:___________ 。
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是___________。

Ⅱ.实验室模拟工业从海藻中提碘的流程如图:
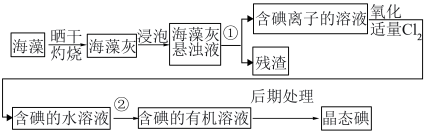
(4)选择合适实验操作名称填入流程图中:①___________ ,②___________ 。(可多选)
A.溶解 B.过滤 C.萃取 D.分液
(5)从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如下图装置完成。装置中间部分是“冷凝管”,请描述该装置中有明显的错误,请写出任一种错误___________ 。
(6)
装置 中,温度计所处的正确位置是
中,温度计所处的正确位置是___________ 。(选填编号)

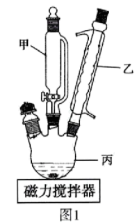
Ⅲ.某化学研究性学习小组模拟工业上从浓缩的海水(海水中富含 )中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:
)中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知: 的沸点为
的沸点为 ,微溶于水,有毒。
,微溶于水,有毒。
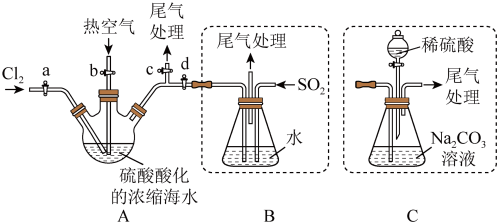
①连接 与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入
与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入 至反应完全:
至反应完全:
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气:
③进行步骤②的同时,向B中通入足量 ;
;
④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量 ;
;
⑤将B中所得液体进行萃取分液,蒸馏并收集液溴
请回答下列问题:
(7)步骤②中鼓入热空气的作用为___________ 。
(8)进行步骤③时,B中尾气可用___________吸收处理。
(9)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中流加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,c中反应生成了NaBrO3、 、
、 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
(10)与B装置相比,采用C装置的优点为___________ 。
I.试剂级
(1)

焙炒海盐的目的是
(2)根据除杂原理、预期沉淀的离子,填写合适的试剂。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | 略过量 | |
| 步骤2 | 略过量 | |
| 步骤3 | 略过量 |
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是___________。

| A.铂片上发生还原反应 |
| B.铂片端作阴极 |
| C.铅笔端有少量的氯气产生 |
| D.a连接的是电源负极 |
Ⅱ.实验室模拟工业从海藻中提碘的流程如图:

(4)选择合适实验操作名称填入流程图中:①
A.溶解 B.过滤 C.萃取 D.分液
(5)从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如下图装置完成。装置中间部分是“冷凝管”,请描述该装置中有明显的错误,请写出任一种错误
(6)

装置

Ⅲ.某化学研究性学习小组模拟工业上从浓缩的海水(海水中富含

①连接
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气:
③进行步骤②的同时,向B中通入足量
④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量
⑤将B中所得液体进行萃取分液,蒸馏并收集液溴
请回答下列问题:
(7)步骤②中鼓入热空气的作用为
(8)进行步骤③时,B中尾气可用___________吸收处理。
| A.水 | B.浓硫酸 | C. | D.饱和 |
(9)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中流加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,c中反应生成了NaBrO3、
(10)与B装置相比,采用C装置的优点为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网