解答题-原理综合题 适中0.65 引用1 组卷150
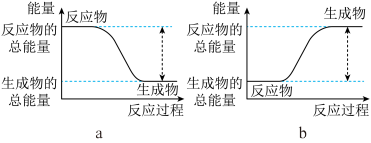
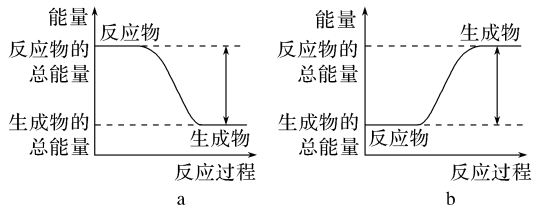
Ⅰ.(1)从能量的变化和反应的快慢等角度研究反应:2H2(g)+O2(g)=2H2O(g)。已知该反应为放热反应,下图能正确表示该反应中能量变化的是__________ 。
从断键和成键的角度分析上述反应中能量的变化,化学键的键能如下表所示:
则生成1molH2O(g)可以放出热量_________________ kJ。
(2)下列反应中,属于放热反应的是_________ ,属于吸热反应的是_________ 。
a.盐酸与烧碱溶液反应 b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.葡萄糖在人体内氧化分解
Ⅱ.A、B、C、D 四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向_____________ 极(填“正”或“负”)。
②装置乙中正极的电极反应式为_________________________ 。
③装置丙中溶液的pH__________________ (填“变大”“变小”或“不变”)。
④四种金属活动性由强到弱的顺序是___________________________ 。

从断键和成键的角度分析上述反应中能量的变化,化学键的键能如下表所示:
| 化学键 | H—H | O=O | H—O |
| 键能(kJ·mol-1) | 436 | 496 | 463 |
则生成1molH2O(g)可以放出热量
(2)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应 b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.葡萄糖在人体内氧化分解
Ⅱ.A、B、C、D 四种金属按下表中装置进行实验。
| 装置 | 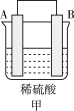 |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属活动性由强到弱的顺序是
19-20高一下·山东临沂·期中
类题推荐
完成下列问题。
(1)下列反应中,属于放热反应的是___________ (填字母,下同),属于吸热反应的是___________ 。
a.盐酸与烧碱溶液反应 b.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.葡萄糖在人体内氧化分解
(2)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。
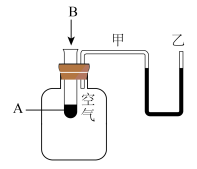
试回答下列问题:
①该反应为___________ 反应(填“放热”或“吸热”)。
②该反应的反应物化学键断裂吸收的能量________ (填“高”或“低”)于生成物化学键形成放出的能量。
(3) A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
①装置甲溶液中的阴离子移向________ (填“A”或“B”)极。
②装置乙中正极的电极反应式为________ 。
③四种金属活动性由强到弱的顺序是________ 。
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如下图所示:
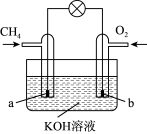
①外电路电子移动方向:___________ (填“a极到b极”或“b极到a极”)。
②a电极的电极方程式为___________ 。
(1)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应 b.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.葡萄糖在人体内氧化分解
(2)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。

试回答下列问题:
①该反应为
②该反应的反应物化学键断裂吸收的能量
(3) A、B、C、D四种金属按下表中装置进行实验。
| 装置 | 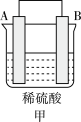 |  |  |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲溶液中的阴离子移向
②装置乙中正极的电极反应式为
③四种金属活动性由强到弱的顺序是
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如下图所示:

①外电路电子移动方向:
②a电极的电极方程式为
回答下列问题。
(1)从能量的变化和反应的快慢等角度研究反应:2H2(g)+O2(g)=2H2O(g)。已知该反应为放热反应,如图能正确表示该反应中能量变化的是_______ 。
从断键和成键的角度分析上述反应中能量的变化,化学键的键能如表所示。
反应2H2(g)+O2(g)=2H2O(g)的ΔH=_______ kJ/mol。生成1 mol H2O(g)可以放出热量是_______ kJ。
(2)下列反应中,属于放热反应的是_______ ,属于吸热反应的是_______ 。
a.盐酸与烧碱溶液反应
b.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
(1)从能量的变化和反应的快慢等角度研究反应:2H2(g)+O2(g)=2H2O(g)。已知该反应为放热反应,如图能正确表示该反应中能量变化的是

从断键和成键的角度分析上述反应中能量的变化,化学键的键能如表所示。
| 化学键 | H—H | O=O | H—O |
| 键能(kJ/mol) | 436 | 496 | 463 |
反应2H2(g)+O2(g)=2H2O(g)的ΔH=
(2)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应
b.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
Ⅰ.完成下列问题
(1)从能量的变化和反应的快慢等角度研究反应:2H2(g)+O2(g)=2H2O(g)。
①已知该反应为放热反应,下图能正确表示该反应中能量变化的是_______ 。
a.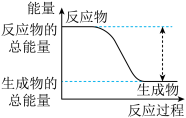 b.
b. 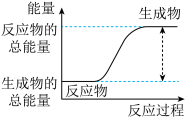
②从断键和成键的角度分析上述反应中能量的变化,化学键的键能如下表所示:
则生成1molH2O(g)可以放出热量_______ kJ。
(2)下列反应中,属于放热反应的是_______ ,属于吸热反应的是_______ 。
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
f.葡萄糖在人体内氧化分解
Ⅱ.完成下列问题
(3)FeCl3溶液常用于腐蚀印刷电路铜板,发生 2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原 电池, 则负极所用电极材料为_______ 。
(4)H2和 O2组合形成的燃料电池的结构如图(电解液是稀硫酸):
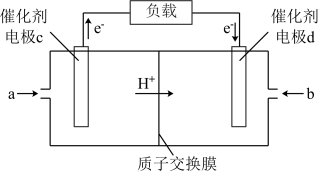
电极 d 的电极反应式为_______ 。
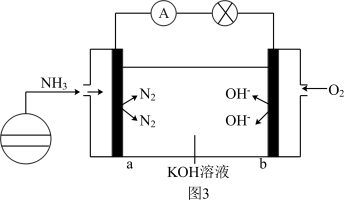
(5)氨氧燃料电池具有很大的发展潜力,其工作原理如图 3 所示。a电极上的反应式为_______ 。
(6)高铁电池是一种新型可充电电池。高铁电池的总反应式为: 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。已知负极反应式为 Zn-2e-+2OH-=Zn(OH)2,则正极反应为
3Zn(OH)2+2Fe(OH)3+4KOH。已知负极反应式为 Zn-2e-+2OH-=Zn(OH)2,则正极反应为_______ 。
(1)从能量的变化和反应的快慢等角度研究反应:2H2(g)+O2(g)=2H2O(g)。
①已知该反应为放热反应,下图能正确表示该反应中能量变化的是
a.
 b.
b. 
②从断键和成键的角度分析上述反应中能量的变化,化学键的键能如下表所示:
| 化学键 | H-H | O=O | H-O |
| 键能(kJ·mol-1) | 436 | 496 | 463 |
则生成1molH2O(g)可以放出热量
(2)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
f.葡萄糖在人体内氧化分解
Ⅱ.完成下列问题
(3)FeCl3溶液常用于腐蚀印刷电路铜板,发生 2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原 电池, 则负极所用电极材料为
(4)H2和 O2组合形成的燃料电池的结构如图(电解液是稀硫酸):

电极 d 的电极反应式为
(5)氨氧燃料电池具有很大的发展潜力,其工作原理如图 3 所示。a电极上的反应式为

(6)高铁电池是一种新型可充电电池。高铁电池的总反应式为: 3Zn+2K2FeO4+8H2O
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


