解答题-原理综合题 适中0.65 引用2 组卷161
一氧化碳可用于制甲酸钠,也可以在冶金工业中作还原剂,还可以作气体燃料,如水煤气(一氧化碳和氢气等气体的混合物)。在恒温恒容密闭容器中发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g)。请回答下列问题:
CO2(g)+H2(g)。请回答下列问题:
(1)加快该反应速率的措施是___ (写两条)。
(2)已知化学键的键能(E)数据如下表:
由此计算生成1mol CO2___ (吸收或放出)能量___ kJ。
(3)判断该反应达到平衡的依据是__ 。
A.正、逆反应速率都为零
B.容器内压强不再变化
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.单位时间内生成1molH2,同时生成1mol CO
(4)若该容器的容积为2L,加入0.2mol的CO和0.2mol的H2O(g),在一定条件下发生反应,反应中CO2的浓度随时间变化情况如图所示:
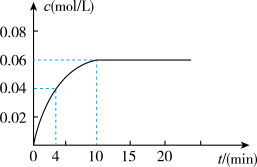
①反应到4min时,H2O(g)的转化率=___ 。
②根据该图数据,反应开始至达到平衡时,CO的平均反应速率v(CO)=___ ;反应达平衡时,H2的体积分数=__ 。
 CO2(g)+H2(g)。请回答下列问题:
CO2(g)+H2(g)。请回答下列问题:(1)加快该反应速率的措施是
(2)已知化学键的键能(E)数据如下表:
| 化学键 | H-H | C=O | C≡O(CO) | H-O |
| E/(kJ/mol) | 436 | 750 | 1076 | 463 |
由此计算生成1mol CO2
(3)判断该反应达到平衡的依据是
A.正、逆反应速率都为零
B.容器内压强不再变化
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.单位时间内生成1molH2,同时生成1mol CO
(4)若该容器的容积为2L,加入0.2mol的CO和0.2mol的H2O(g),在一定条件下发生反应,反应中CO2的浓度随时间变化情况如图所示:

①反应到4min时,H2O(g)的转化率=
②根据该图数据,反应开始至达到平衡时,CO的平均反应速率v(CO)=
20-21高二上·四川眉山·开学考试
类题推荐
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇;发生的主反应如下:
i. CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
iii. CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应ii中的相关的化学键键能(“C O”表示CO的化学键)数据见表:
O”表示CO的化学键)数据见表:
由此计算△H2=________ kJ·mol-1; 已知△H1=-58kJ·mol-1,则△H3=________ kJ·mol-1
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为_______________ 。
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i 。下图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反
应的化学反应速率为_____________________ 。
②若改充入1mol CO2和3mol H2,则图1中的曲线会_________ (填“上移”或“下移”)。
(4)某温度下在容积为2L的密闭容器中充入1mol CO和2mol H2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。

①5min至10min时速率变化的原因可能是_________ ;
②反应ii在10min时达平衡,此时平衡常数K=_________ (保留两位有效数字)。
③若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是________ ;
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
i. CO2(g)+3H2(g)
ii. CO(g)+2H2(g)
iii. CO2(g)+H2(g)
回答下列问题:
(1)已知反应ii中的相关的化学键键能(“C
 O”表示CO的化学键)数据见表:
O”表示CO的化学键)数据见表: 化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H2=
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i 。下图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反
应的化学反应速率为
②若改充入1mol CO2和3mol H2,则图1中的曲线会
(4)某温度下在容积为2L的密闭容器中充入1mol CO和2mol H2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。

①5min至10min时速率变化的原因可能是
②反应ii在10min时达平衡,此时平衡常数K=
③若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii.CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
iii.CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应ii中的相关的化学键键能(“C O”表示CO的化学键)数据见表:由此计算△H2=
O”表示CO的化学键)数据见表:由此计算△H2=___ kJ·mol-1。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为___ 。
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i。图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为___ 。
②若改充入1molCO2和3mol H2,则图1中的曲线会___ (填“上移”或“下移”)。
(4)某温度下在容积为2L的密闭容器中充入1molCO和2molH2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。

①5min至10min时速率变化的原因可能是___ ;
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是___ ;
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,仅增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为___ mol(保留两位有效数字)。
i.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1ii.CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2iii.CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3回答下列问题:
| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
 O”表示CO的化学键)数据见表:由此计算△H2=
O”表示CO的化学键)数据见表:由此计算△H2=(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i。图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为
②若改充入1molCO2和3mol H2,则图1中的曲线会
(4)某温度下在容积为2L的密闭容器中充入1molCO和2molH2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。

①5min至10min时速率变化的原因可能是
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,仅增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1;
CH3OH(g)+H2O(g) △H1;
②CO(g)+2H2(g) CH3OH(g) △H2 ③CO2(g)+H2(g)
CH3OH(g) △H2 ③CO2(g)+H2(g) CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;
回答下列问题:
(1)已知反应①中的相关的化学键键能(“C O”表示CO的化学键)数据见表:由此计算△H2=
O”表示CO的化学键)数据见表:由此计算△H2=________ kJ·mol-1,已知△H1=-58kJ·mol-1,则△H3=________ kJ·mol-1
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为_______________ 。
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应①。
下如图是反应体系中CO2的平衡转化率与温度的关系曲线。
①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为_____________________ 。
②若改充入1mol CO2 和3mol H2,则如图1中的曲线会_________ (填“上移”或“下移”)。
(4)某温度下在容积为2L的密闭容器中充入1mol CO和2mol H2合成甲醇,发生反应②,各组分的物质的量随时间的变化情况如上如图所示。
①5min至10min时速率变化的原因可能是_____________ ;
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是____________ 。
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,仅增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为_________ mol(保留两位有效数字)。
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1;
CH3OH(g)+H2O(g) △H1;②CO(g)+2H2(g)
 CH3OH(g) △H2 ③CO2(g)+H2(g)
CH3OH(g) △H2 ③CO2(g)+H2(g) CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;回答下列问题:
| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应①中的相关的化学键键能(“C
 O”表示CO的化学键)数据见表:由此计算△H2=
O”表示CO的化学键)数据见表:由此计算△H2=(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应①。
下如图是反应体系中CO2的平衡转化率与温度的关系曲线。
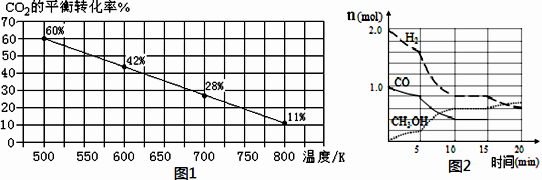
①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为
②若改充入1mol CO2 和3mol H2,则如图1中的曲线会
(4)某温度下在容积为2L的密闭容器中充入1mol CO和2mol H2合成甲醇,发生反应②,各组分的物质的量随时间的变化情况如上如图所示。
①5min至10min时速率变化的原因可能是
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,仅增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


