解答题-原理综合题 较难0.4 引用1 组卷268
CO和H2的混合气体俗称合成气,是一种重要的工业原料气。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)已知:CH4、H2和CO 的燃烧热(ΔH)分别为-890.3 kJ/mol、-285.8 kJ/mol和-283.0kJ/mol,且1 mol液态水汽化时的能量变化为44.0 kJ。则甲烷与水蒸气在高温下反应制取合成气的热化学方程式为_______ 。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40 mol CH4(g)和0.60 mol H2O (g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如表所示:
①计算该反应第一次达平衡时的平衡常数K=_____ 。
②3 min时改变的反应条件可能是_____ 。
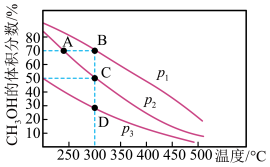
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。
①图1中的两条曲线所示的投料比的关系:X1____ X2(填“=”“>”或“<”,下同)。
②图2中两条曲线所示的压强的关系:p1_______ p2。
(4)以合成气为原料可以制备二甲醚,将n(H2):n(CO)=3:1 投入体积固定密闭容器中发生反应:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ΔH<0,2 分钟达平衡。升温,反应重新达平衡。下列关于两次平衡的比较中正确的是_______ 。
A.H2体积分数不变
B.CO 体积分数增大
C.混合气体平均摩尔质量不变
D.反应速率和平衡常数均增大
(5)以二甲醚(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为________ 。
②设装置中盛有100.0 mL 3.0 mol/L KOH 溶液,放电时参与反应的氧气在标准状况下的体积为6.72 L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为_______ 。
(1)已知:CH4、H2和CO 的燃烧热(ΔH)分别为-890.3 kJ/mol、-285.8 kJ/mol和-283.0kJ/mol,且1 mol液态水汽化时的能量变化为44.0 kJ。则甲烷与水蒸气在高温下反应制取合成气的热化学方程式为
(2)在一定温度下,向体积为2L的密闭容器中充入0.40 mol CH4(g)和0.60 mol H2O (g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如表所示:
| t/min | 0 | 1 | 2 | 3 | 4 |
| CH4/(mol/L) | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
| H2/(mol/L) | 0 | 0.2 | 0.3 | 0.3 | 0.33 |
①计算该反应第一次达平衡时的平衡常数K=
②3 min时改变的反应条件可能是
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。

①图1中的两条曲线所示的投料比的关系:X1
②图2中两条曲线所示的压强的关系:p1
(4)以合成气为原料可以制备二甲醚,将n(H2):n(CO)=3:1 投入体积固定密闭容器中发生反应:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ΔH<0,2 分钟达平衡。升温,反应重新达平衡。下列关于两次平衡的比较中正确的是
A.H2体积分数不变
B.CO 体积分数增大
C.混合气体平均摩尔质量不变
D.反应速率和平衡常数均增大
(5)以二甲醚(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为
②设装置中盛有100.0 mL 3.0 mol/L KOH 溶液,放电时参与反应的氧气在标准状况下的体积为6.72 L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为
2020·贵州铜仁·三模
类题推荐
Ⅰ.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为_____________________________________________________ 。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应: CH4(g) + H2O(g) ⇌ CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
①该反应第一次达平衡时的平衡常数K=_______________ 。
②3min时改变的反应条件是__________________ (只填一种条件的改变即可)。
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。图1中的两条曲线所示投料比的关系X1______ X2(填“=”、“>”或“<”)。

Ⅱ.(4)已知常温下HCOOH的电离常数为 ,则HCOO—的水解反应HCOO- + H2O ⇌HCOOH + OH-的平衡常数K h =
,则HCOO—的水解反应HCOO- + H2O ⇌HCOOH + OH-的平衡常数K h =__________________ 。
(5)常温下,将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,溶液中各离子浓度由大到小的顺序是______________________________ 。
(6)常温下,在a mol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为______________________ 。
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应: CH4(g) + H2O(g) ⇌ CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
| 时间/min 物质的浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
| H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
①该反应第一次达平衡时的平衡常数K=
②3min时改变的反应条件是
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。图1中的两条曲线所示投料比的关系X1

Ⅱ.(4)已知常温下HCOOH的电离常数为
(5)常温下,将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,溶液中各离子浓度由大到小的顺序是
(6)常温下,在a mol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为
以氢气、一氧化碳为主要组分的合成气是一种重要的化工原料,可以合成二甲醚、甲醇等许多重要的化工产品。回答下列问题:
(1)已知反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(l) △H1=-2.8kJ·mol-1
CO(g)+H2O(l) △H1=-2.8kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H2=-122.5kJ·mol-1
CH3OCH3(g)+3H2O(g) △H2=-122.5kJ·mol-1
1mol液态水全部蒸发为气态水吸收44.0kJ的能量,则以气态CO和气态H2为原料制备气态CH3OCH3和水蒸气的热化学方程式是___ 。
(2)在一温度恒定的密闭容器中通入一定量的CO和H2,在催化剂作用下转化为CH3OCH3(g),当CO与H2的投料比为____ 时,混合气体CH3OCH3的体积分数最大;为了提高CH3OCH3的平衡产率,不改变温度,可以采取的措施有____ (答出一条即可)。
(3)改用不同的催化剂可以利用合成气制备甲醇,反应方程式为CO(g)+2H2(g) CH3OCH3(g) △H<0,v正=k正x(CO)·x2(H2),v逆=k逆x(CH3OCH3),k正、k逆分别为正逆反应速率常数,x为物质的量分数。
CH3OCH3(g) △H<0,v正=k正x(CO)·x2(H2),v逆=k逆x(CH3OCH3),k正、k逆分别为正逆反应速率常数,x为物质的量分数。
①该反应在某条件下达到平衡后,降低温度,k正___ (填“增大”或“减小,下同),k逆___ ,且k正的变化程度___ (填“大于”“小于”“等于”)k逆变化的程度。
②在实验室模拟工业合成甲醇的反应,在一恒压密闭容器内充入1mol CO、2mol H2和1mol He(代替合成气中的杂质,不参与反应),测得压强为pMPa,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如表:
则氢气的平衡转化率为___ ,该温度下的平衡常数Kp为____ (MPa)-2(Kp为以分压表示的平衡常数,请用含p的式子表示)。
(4)利用二氧化碳和甲烷经催化重整,可以制得合成气:CO2(g)+CH4(g) 2CO(g)+2H2(g),按一定体积比加入甲烷和二氧化碳,在恒容条件下发生反应,温度对CO和H2产率的影响如图所示。则下列叙述正确的是
2CO(g)+2H2(g),按一定体积比加入甲烷和二氧化碳,在恒容条件下发生反应,温度对CO和H2产率的影响如图所示。则下列叙述正确的是___ 。

(1)已知反应Ⅰ:CO2(g)+H2(g)
反应Ⅱ:2CO2(g)+6H2(g)
1mol液态水全部蒸发为气态水吸收44.0kJ的能量,则以气态CO和气态H2为原料制备气态CH3OCH3和水蒸气的热化学方程式是
(2)在一温度恒定的密闭容器中通入一定量的CO和H2,在催化剂作用下转化为CH3OCH3(g),当CO与H2的投料比为
(3)改用不同的催化剂可以利用合成气制备甲醇,反应方程式为CO(g)+2H2(g)
①该反应在某条件下达到平衡后,降低温度,k正
②在实验室模拟工业合成甲醇的反应,在一恒压密闭容器内充入1mol CO、2mol H2和1mol He(代替合成气中的杂质,不参与反应),测得压强为pMPa,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如表:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 容器体积/L | 4 | 3.5 | 3.2 | 3.0 | 2.9 | 2.8 | 2.8 |
(4)利用二氧化碳和甲烷经催化重整,可以制得合成气:CO2(g)+CH4(g)

| A.该反应△H>0 |
| B.此反应的优选温度为1000℃ |
| C.在恒压条件下进行该反应,产率将更高 |
| D.催化剂的使用可以降低反应的活化能,从而使平衡产率提高 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网