填空题 适中0.65 引用1 组卷64
按要求回答下列问题:
I.某温度时,在2L密闭容器中某一反应中气体A、B的物质的量随时间变化的曲线如下图所示,回答下列问题:
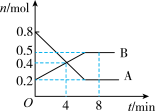
(1)该反应的化学方程式为________ 。
(2)0~4min内,用A表示反应速率v(A)=______ 。
(3)反应达平衡时容器内混合气体的平均相对分子质量比起始时______ (填“变大”、“变小”或“相等”)。
(4)下列措施能加快反应速率的是_______ 。
A.缩小体积,使压强增大 B.恒温恒容充入He气 C.恒温恒压充入He气 D.使用催化剂
Ⅱ.化学能与电能之间可以相互转化。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_________
A.Ba(OH)2·8H2O与NH4Cl反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与CO2反应 D.H2与Cl2燃烧反应
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
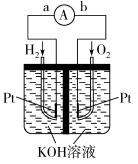
①电池的负极反应式为:_______ 。
②电池工作时OH-向移动_______ (填“正极”或“负极”)。
③正极上消耗标况下4.48L气体时,转移电子的数目为________ 。
I.某温度时,在2L密闭容器中某一反应中气体A、B的物质的量随时间变化的曲线如下图所示,回答下列问题:

(1)该反应的化学方程式为
(2)0~4min内,用A表示反应速率v(A)=
(3)反应达平衡时容器内混合气体的平均相对分子质量比起始时
(4)下列措施能加快反应速率的是
A.缩小体积,使压强增大 B.恒温恒容充入He气 C.恒温恒压充入He气 D.使用催化剂
Ⅱ.化学能与电能之间可以相互转化。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是
A.Ba(OH)2·8H2O与NH4Cl反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与CO2反应 D.H2与Cl2燃烧反应
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①电池的负极反应式为:
②电池工作时OH-向移动
③正极上消耗标况下4.48L气体时,转移电子的数目为
19-20高一下·黑龙江齐齐哈尔·期末
类题推荐
I.根据所学知识,按要求回答下列问题:
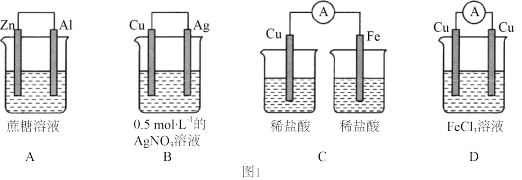
(1)如图1所示的四种装置中可以构成原电池的是_______ (填字母)。能构成原电池的装置中,负极材料是_______ (填元素符号),反应一段时间后,电解质溶液质量_______ (填“增大“减小”或“不变”),正极的电极反应式为_______ 。
(2)原电池可以将化学能直接转化为电能,根据这一原理推测,能设计原电池的氧化还原反应应该是_______ (填“吸热”或“放热”)反应,下列物质之间的化学变化能设计成原电池的是_______ (填字母)。
A.碳与二氧化碳反应 B.碳酸氢钠与盐酸应
C.氢气与氧气反应 D.氢氧化钠与盐酸反应
II.NO2(红棕色)和N2O4(无色)之间发生反应:N2O4(g) 2NO2(g)。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
2NO2(g)。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
(3)下列可以说明该反应达到平衡的是 _______ (填标号)。
(4)在温度为T的条件下,向该恒容密闭容器中充入0.04 mol·L-1 N2O4,c(NO2)随时间的变化曲线如图所示。
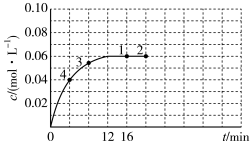
①请在图上画出N2O4的浓度随时间的变化曲线_______
②该条件下,N2O4的平衡转化率是_______ 。
③下列措施能使该反应速率加快的是:_______ (填标号)。
A.增大NO2的浓度 B.增大容器体积 C.加入合适的催化剂 D.恒容条件下充入He
(1)如图1所示的四种装置中可以构成原电池的是

(2)原电池可以将化学能直接转化为电能,根据这一原理推测,能设计原电池的氧化还原反应应该是
A.碳与二氧化碳反应 B.碳酸氢钠与盐酸应
C.氢气与氧气反应 D.氢氧化钠与盐酸反应
II.NO2(红棕色)和N2O4(无色)之间发生反应:N2O4(g)
(3)下列可以说明该反应达到平衡的是 _______ (填标号)。
| A.c(N2O4):c(NO2)=1:2 | B.v正(N2O4)=2v逆(NO2) |
| C.容器内气体的颜色不再变化 | D.混合气体的压强不再变化 |

①请在图上画出N2O4的浓度随时间的变化曲线
②该条件下,N2O4的平衡转化率是
③下列措施能使该反应速率加快的是:
A.增大NO2的浓度 B.增大容器体积 C.加入合适的催化剂 D.恒容条件下充入He
NO2(红棕色)和N2O4(无色)之间发生反应:N2O4(g) 2NO2(g)。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
2NO2(g)。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
(1)该反应为吸热反应,则反应物的化学键断裂要吸收的能量____ (填“大于”、“小于”或“等于”)生成物的化学键形成要放出的能量。
(2)下列可以说明该反应达到平衡的是____ 。
(3)在温度为T的条件下,向该恒容密闭容器中充入0.04mol·L-1N2O4,c(NO2)随时间的变化曲线如图所示。
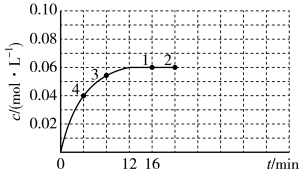
①在图中画出0~16min时间段内,c(N2O4)随时间的变化曲线____ 。
②1~4四个点中,v正=v逆的点有____ 。
③反应进行到16min时,N2O4的转化率是____ 。
④下列措施能使该反应速率加快的是____ 。
A.增大NO2的浓度 B.增大容器体积
C.加入合适的催化剂 D.恒容条件下充入He
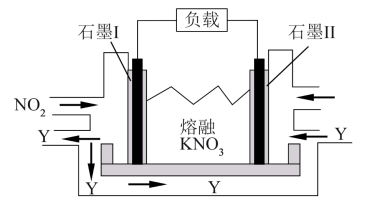
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则正极反应式为____ 。
(1)该反应为吸热反应,则反应物的化学键断裂要吸收的能量
(2)下列可以说明该反应达到平衡的是
| A.c(N2O4):c(NO2)=1:2 | B.v正(N2O4)=2v逆(NO2) |
| C.容器内气体的颜色不再变化 | D.混合气体的压强不再变化 |

①在图中画出0~16min时间段内,c(N2O4)随时间的变化曲线
②1~4四个点中,v正=v逆的点有
③反应进行到16min时,N2O4的转化率是
④下列措施能使该反应速率加快的是
A.增大NO2的浓度 B.增大容器体积
C.加入合适的催化剂 D.恒容条件下充入He
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则正极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



