解答题-原理综合题 适中0.65 引用1 组卷54
CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的二氧化碳为原料可以制取甲醇。一定条件下,在恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ ·mol-1
CH3OH(l)= CH3OH(g)△H=+35.2kJ·mol-1
H2O(l)=H2O(g)△H=+44kJ·mol-1。
则CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=
CH3OH(g)+H2O(g)△H=_____ kJ·mol-1。有利于提高H2平衡转化率的条件是_______ (填选项字母)。
A高温低压B低温高压C高温高压D低温低压
②某温度下,向体积为2L的容器中充入6molH2、4molCO2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为____ (保留两位有效数字)。
③起始条件(T1℃、2L密闭容器)如下表所示:

达到平衡时,该反应的平衡常数K(I)____ K(II)(填“>”“<”或“=”,下同)。平衡时CH3OH的浓度:c(I)______ c(II)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)→CH2=CH2(g)+4H2O(g)△H= -127.8 kJ·mol-1。0.1MPa下,按n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(φ)如图所示:
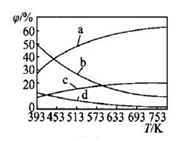
①曲线b、c表示的物质分别为_________________ (填化学式)。
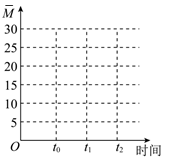
②保持温度不变,在体积为VL的恒容容器中以n(CO2):n(H2)=2:3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象_________
(3)工业上,还可以利用太阳能以CO2为原料制取C,使得二氧化碳资源化,其原理如下图所示:
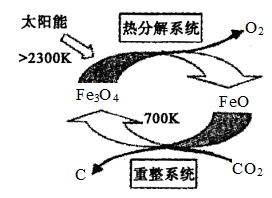
整个过程中____ (填“Fe3O4”或“FeO”)是反应的催化剂。重整系统中每生成1mol Fe3O4,转移电子的物质的量为____ 。
(1)利用废气中的二氧化碳为原料可以制取甲醇。一定条件下,在恒容密闭容器中发生反应:CO2(g)+3H2(g)
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ ·mol-1
CH3OH(l)= CH3OH(g)△H=+35.2kJ·mol-1
H2O(l)=H2O(g)△H=+44kJ·mol-1。
则CO2(g)+3H2(g)
A高温低压B低温高压C高温高压D低温低压
②某温度下,向体积为2L的容器中充入6molH2、4molCO2,发生反应CO2(g)+3H2(g)
③起始条件(T1℃、2L密闭容器)如下表所示:

达到平衡时,该反应的平衡常数K(I)
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)→CH2=CH2(g)+4H2O(g)△H= -127.8 kJ·mol-1。0.1MPa下,按n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(φ)如图所示:

①曲线b、c表示的物质分别为
②保持温度不变,在体积为VL的恒容容器中以n(CO2):n(H2)=2:3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象

(3)工业上,还可以利用太阳能以CO2为原料制取C,使得二氧化碳资源化,其原理如下图所示:

整个过程中
19-20高二上·山西晋中·阶段练习
类题推荐
CCUS是一种二氧化碳的捕获、利用与封存技术,这种技术可将CO2资源化,产生经济效益,也为我国实现“绿水青山”工程提供支撑。请回答下列问题:
(1)利用废气中的二氧化碳为原料可以制取甲醇。一定条件下,在恒容密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
已知:H2(g)、CH3OH(g)的燃烧热(∆H)分别为-285.8 kJ⋅mol−1和-761.7 kJ⋅mol−1;
H2O(l)=H2O(g) ∆H=+44kJ⋅mol−1,则CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=______ kJ⋅mol−1。有利于提高H2平衡转化率的条件是______ (填字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)某温度下,向体积为2L的容器中充入6mol H2、4mol CO2,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为______ (结果精确到0.001)。
(3)一定温度下,在两个容积均为2L的恒容密闭容器中,起始条件如下表所示:
则c1______ c2 (填“>”、“<”或“=”)。
(4)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) ∆H=−127.8kJ⋅mol−1。0.1MPa下,按n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时四种气态物质的质量分数(φ)如图所示:
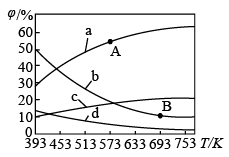
①曲线b、c表示的物质分别为______ (填化学式)。
②A、B两点对应温度下反应的平衡常数大小关系为K(A)______ K(B)(填“大于”、“小于”或“等于”)。
(1)利用废气中的二氧化碳为原料可以制取甲醇。一定条件下,在恒容密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
已知:H2(g)、CH3OH(g)的燃烧热(∆H)分别为-285.8 kJ⋅mol−1和-761.7 kJ⋅mol−1;
H2O(l)=H2O(g) ∆H=+44kJ⋅mol−1,则CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)某温度下,向体积为2L的容器中充入6mol H2、4mol CO2,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为
(3)一定温度下,在两个容积均为2L的恒容密闭容器中,起始条件如下表所示:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
(4)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) ∆H=−127.8kJ⋅mol−1。0.1MPa下,按n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时四种气态物质的质量分数(φ)如图所示:

①曲线b、c表示的物质分别为
②A、B两点对应温度下反应的平衡常数大小关系为K(A)
CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g)△H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) 2CH3OH(g)△H2=+23.4kJ·mol-1
2CH3OH(g)△H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H3
CH3OCH3(g)+3H2O(g)△H3
(1)△H3=_____________ kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______ (填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
此时
___  (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数V(CH3OH)%=
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数V(CH3OH)%=_____ %。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____ 。

(5)恒压下将CO2和氏按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性= ×100%
×100%

①温度高于230℃,CH3OH产率随温度升高而下降的原因是________ 。
②在上述条件下合成甲醇的工业条件是_________ 。
A. 230℃ B. 210℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
反应I:CO2(g)+3H2(g)
反应II:CH3OCH3(g)+H2O(g)
反应III:2CO2(g)+6H2(g)
(1)△H3=
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
| 物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
| 浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=

(5)恒压下将CO2和氏按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=

①温度高于230℃,CH3OH产率随温度升高而下降的原因是
②在上述条件下合成甲醇的工业条件是
A. 230℃ B. 210℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
近年碳中和理念成为热门,通过“CO2→合成气→高附加值产品”的工艺路线,可有效实现CO2的资源化利用。请回答下列问题:
(1)CO2加氢制合成气(CO、H2)时发生下列反应:
已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+206.2kJ∙mol-1
②CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ∆H=-165.0kJ∙mol-1
则CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H=___________ kJ/mol
(2)CO2经催化加氢可合成烯烃:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ∆H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
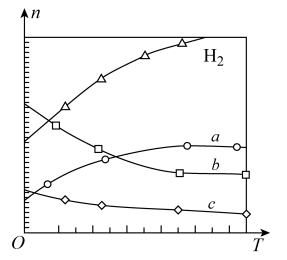
①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是___________ (填字母)。
A.容器内各物质的浓度不随时间变化
B.2v正(CO2)=3v逆(H2)
C.容器内压强不随时间变化
D.混合气体的密度不再改变
②该反应的
___________ 0(填“>”或“<”),理由是___________ 。
③曲线c表示的物质为___________ (用化学式表示)。
④为提高H2的转化率,可以采取什么措施___________ (至少写出2种)。
(3)由CO2与H2反应合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H。某温度下将1molCO2和3molH2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
该条件下的分压平衡常数Kp___________ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)CO2加氢制合成气(CO、H2)时发生下列反应:
已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+206.2kJ∙mol-1
②CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ∆H=-165.0kJ∙mol-1
则CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H=
(2)CO2经催化加氢可合成烯烃:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ∆H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是
A.容器内各物质的浓度不随时间变化
B.2v正(CO2)=3v逆(H2)
C.容器内压强不随时间变化
D.混合气体的密度不再改变
②该反应的
③曲线c表示的物质为
④为提高H2的转化率,可以采取什么措施
(3)由CO2与H2反应合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H。某温度下将1molCO2和3molH2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
| 时间/h | 1 | 2 | 3 | 4 | 5 |
| 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |
该条件下的分压平衡常数Kp
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


