解答题-原理综合题 较难0.4 引用1 组卷111
CO2的综合利用是解决温室效应及能源问题的有效途径。
(1)CO2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H=-726.5kJ/mol、△H=-285.8kJ/mol,且1mol水蒸气转化为液态水时放出44kJ的热量。
则CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=
CH3OH(g)+H2O(g)△H=__ kJ/mol。
(2)下列措施有利于提高CO2转化为CH3OH的平衡转化率的措施有__ (填字母代号)。
a.使用适当的催化剂
b.缩小体积增大体系压强
c.降温并及时分离出CH3OH
d.增大CO2和H2的初始投料比
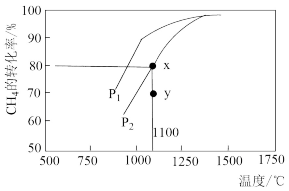
(3)CO2和CH4反应制取氢气:CO2(g)+CH4(g) 2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强P1
2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强P1___ P2(填“大于”或“小于”);压强为P2时,在y点反应___ (填“正”或“逆”)向进行。
(4)CO2也可用于合成碳酸二甲酯(DMC)。一定温度时,在容积为2.0L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-2mol催化剂,容器中发生反应:2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+H2O(g)△H=-15.5kJ/mol。甲醇转化数(TON)与反应时间的关系如图所示。则该温度时,甲醇的最高转化率为
CH3OCOOCH3(g)+H2O(g)△H=-15.5kJ/mol。甲醇转化数(TON)与反应时间的关系如图所示。则该温度时,甲醇的最高转化率为__ 。4~7h内DMC的平均反应速率是__ (保留两位小数)。
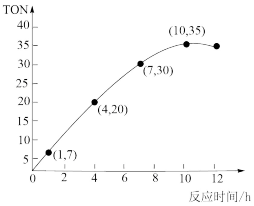
已知:TON=
(1)CO2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H=-726.5kJ/mol、△H=-285.8kJ/mol,且1mol水蒸气转化为液态水时放出44kJ的热量。
则CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=
CH3OH(g)+H2O(g)△H=(2)下列措施有利于提高CO2转化为CH3OH的平衡转化率的措施有
a.使用适当的催化剂
b.缩小体积增大体系压强
c.降温并及时分离出CH3OH
d.增大CO2和H2的初始投料比
(3)CO2和CH4反应制取氢气:CO2(g)+CH4(g)
 2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强P1
2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强P1
(4)CO2也可用于合成碳酸二甲酯(DMC)。一定温度时,在容积为2.0L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-2mol催化剂,容器中发生反应:2CH3OH(g)+CO2(g)
 CH3OCOOCH3(g)+H2O(g)△H=-15.5kJ/mol。甲醇转化数(TON)与反应时间的关系如图所示。则该温度时,甲醇的最高转化率为
CH3OCOOCH3(g)+H2O(g)△H=-15.5kJ/mol。甲醇转化数(TON)与反应时间的关系如图所示。则该温度时,甲醇的最高转化率为
已知:TON=
19-20高二上·湖南长沙·期中
类题推荐
利用化学反应原理研究化学反应有重要意义。
(1)CO2的减排和综合利用是解决温室及能源问题的有效途径。一定温度下,在体积为1L的密闭容器中,充入1 molCO2和3molH2,此时压强为p0kpa,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
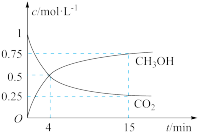
①0~4min,H2的平均反应速率v(H2)=__ mol·L−1·min−1。
②下列能说明该反应已达到平衡状态的是___ 。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒容下,气体的密度不再变化
D.恒温恒压下,气体的体积不再变化
③测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)___ v(逆)(填“>”“<”或“=”)。
④可逆反应的平衡常数可用平衡分压代替平衡浓度计算,已知:分压=总压×物质的量分数,则该温度下Kp=___ kPa-2(用含有p0的式子表示,保留1位小数)。
(2)工业中,CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应B:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图所示。
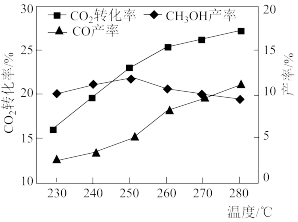
图为温度对CO2平衡转化率及甲醇和CO产率的影响
①由图可知温度升高时CO的产率上升,其主要原因可能是___ 。
②由图可知获取CH3OH最适宜的温度是___ 。下列措施有利于提高CO2转化为CH3OH的平衡转化率的有___ (填字母)。
A.使用对反应A选择性更高的催化剂
B.压缩体积
C.增大CO2和H2的初始投料比
(3)合成氨是人类科学技术上的一项重大突破,反应原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1。在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得合成氨反应达到平衡时的有关数据如下。
2NH3(g) ΔH=-92.4kJ·mol-1。在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得合成氨反应达到平衡时的有关数据如下。
则a+b___ 92.4(填“>”、“=”或“<”,下同),c3___ 2c1,2p2___ p3,α1+α3___ 1。
(1)CO2的减排和综合利用是解决温室及能源问题的有效途径。一定温度下,在体积为1L的密闭容器中,充入1 molCO2和3molH2,此时压强为p0kpa,发生反应:CO2(g)+3H2(g)

①0~4min,H2的平均反应速率v(H2)=
②下列能说明该反应已达到平衡状态的是
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒容下,气体的密度不再变化
D.恒温恒压下,气体的体积不再变化
③测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)
④可逆反应的平衡常数可用平衡分压代替平衡浓度计算,已知:分压=总压×物质的量分数,则该温度下Kp=
(2)工业中,CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A:CO2(g)+3H2(g)
反应B:CO2(g)+H2(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图所示。

图为温度对CO2平衡转化率及甲醇和CO产率的影响
①由图可知温度升高时CO的产率上升,其主要原因可能是
②由图可知获取CH3OH最适宜的温度是
A.使用对反应A选择性更高的催化剂
B.压缩体积
C.增大CO2和H2的初始投料比
(3)合成氨是人类科学技术上的一项重大突破,反应原理为:N2(g)+3H2(g)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
则a+b
目前,CO、CO2的有效开发利用成为科学家研究的重要课题。
Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ/mol、-285.8kJ/mol、-764.5kJ/mol。则CO(g)+2H2(g) CH3OH(g)的∆H=__________。
CH3OH(g)的∆H=__________。
(2)将1molCO和2molH2充入密闭容器中发生上述反应。其他条件相同时,CO的平衡转化率[α(CO)]与压强(P)和温度(T)的关系如图所示
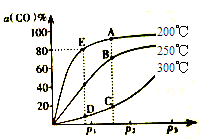
①A、B两点CH3OH的质量分数ω(A)______ω(B)(填“>”、“<”或“=”),理由为__________。
②C、D两点的逆反应速率:v逆(C)______v逆(D)(填“>”、“<”或“=”),理由为_________。
③200℃时,测得E点的容器容积为10L。该温度下,反应的平衡常数K=__________;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为________。
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景。T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H<0,其它条件不变,下列措施中能使n(CH3OH)/n(CO2)增大的是_________(填选项字母)。
CH3OH(g)+H2O(g) ∆H<0,其它条件不变,下列措施中能使n(CH3OH)/n(CO2)增大的是_________(填选项字母)。
A.升高温度
B.再充入1molCH3OH(g)和1molH2O(g)
C.加入催化剂
D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐。已知:25℃时,几种酸的电离平衡常数如下表所示。
25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:①NaHC2O4②HNO2③HClO溶液中的n(HCO3-)与所加入溶液体积(V)的关系如图所示。其中,符合曲线Ⅰ的溶液为__________(填序号,下同);符合曲线Ⅱ的溶液为___________。
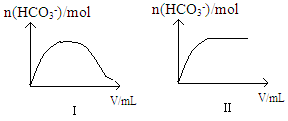
Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ/mol、-285.8kJ/mol、-764.5kJ/mol。则CO(g)+2H2(g)
 CH3OH(g)的∆H=__________。
CH3OH(g)的∆H=__________。(2)将1molCO和2molH2充入密闭容器中发生上述反应。其他条件相同时,CO的平衡转化率[α(CO)]与压强(P)和温度(T)的关系如图所示

①A、B两点CH3OH的质量分数ω(A)______ω(B)(填“>”、“<”或“=”),理由为__________。
②C、D两点的逆反应速率:v逆(C)______v逆(D)(填“>”、“<”或“=”),理由为_________。
③200℃时,测得E点的容器容积为10L。该温度下,反应的平衡常数K=__________;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为________。
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景。T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H<0,其它条件不变,下列措施中能使n(CH3OH)/n(CO2)增大的是_________(填选项字母)。
CH3OH(g)+H2O(g) ∆H<0,其它条件不变,下列措施中能使n(CH3OH)/n(CO2)增大的是_________(填选项字母)。A.升高温度
B.再充入1molCH3OH(g)和1molH2O(g)
C.加入催化剂
D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐。已知:25℃时,几种酸的电离平衡常数如下表所示。
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:①NaHC2O4②HNO2③HClO溶液中的n(HCO3-)与所加入溶液体积(V)的关系如图所示。其中,符合曲线Ⅰ的溶液为__________(填序号,下同);符合曲线Ⅱ的溶液为___________。
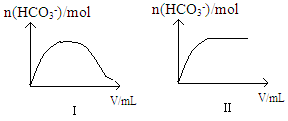
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网





