填空题 适中0.65 引用1 组卷67
我国首创以铝组成的金属—海水—空气电池作为新型海水标志灯的能源,它以海水为电解质溶液,靠空气中的氧气使铝组成的金属不断氧化而产生电流。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为__________ ;
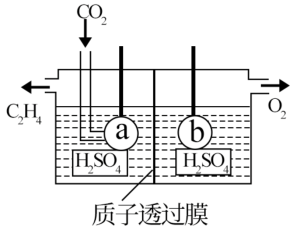
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的__________ 极,该电极反应式为__________ ;
(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为__________ ;
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为__________ ;
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+ ,写出正极反应式
,写出正极反应式__________ 。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的

(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+
19-20高二下·内蒙古赤峰·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2CO(g)
2CO(g)