解答题-原理综合题 适中0.65 引用1 组卷94
我们的生活离不开化学。化学物质在不同的领域发挥着重要的作用。
(1)目前科学家探索利用甲烷将氮氧化物还原为氮气和水,反应机理如下:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H= —574kJ•mol-1
CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) △H= —1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为__________ 。
(2)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时发生如下分解反应: 2Mg5Al3(OH)19(H2O)4 27H2O +10MgO+3Al2O3写出该化合物作阻燃剂的两条依据:
27H2O +10MgO+3Al2O3写出该化合物作阻燃剂的两条依据:__________ 、__________ 。
(3)焦亚硫酸钠(Na2S2O5)是一种常见的食品抗氧化剂。
①焦亚硫酸钠(Na2S2O5)中硫元素的化合价为_______ 。
②向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为__________ 。
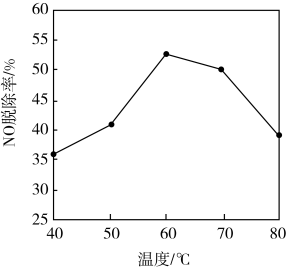
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。下列说法正确的是________ 。
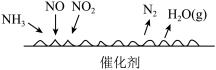
A.由图可知SCR技术中NO、NO2为氧化剂
B.若用Fe做催化剂时,在氨气足量的情况下,当c(NO2)∶c(NO)=1∶1时,脱氮率最佳
C.每生成1molN2,转移电子3mol
D.催化剂通过参与反应降低反应的活化能,提高平衡转化率
(1)目前科学家探索利用甲烷将氮氧化物还原为氮气和水,反应机理如下:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H= —574kJ•mol-1
CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) △H= —1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(2)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时发生如下分解反应: 2Mg5Al3(OH)19(H2O)4
(3)焦亚硫酸钠(Na2S2O5)是一种常见的食品抗氧化剂。
①焦亚硫酸钠(Na2S2O5)中硫元素的化合价为
②向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。下列说法正确的是

A.由图可知SCR技术中NO、NO2为氧化剂
B.若用Fe做催化剂时,在氨气足量的情况下,当c(NO2)∶c(NO)=1∶1时,脱氮率最佳
C.每生成1molN2,转移电子3mol
D.催化剂通过参与反应降低反应的活化能,提高平衡转化率
20-21高三上·山东威海·期中
类题推荐
(1)为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2﹣。

以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式__________________________ ,已知一个电子的电量是1.602×10﹣19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成
NaOH______ g。
(2)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=﹣574kJ•mol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=﹣1160kJ•mol﹣1
则甲烷直接将NO2还原为N2的热化学方程式为:_________________________ 。
(3)某温度时,向AgNO3溶液中加入K2CrO4溶液会生成Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.

①该温度下,下列说法正确的是____ .
②若常温下Ksp[Cr(OH)3]=10﹣32,要使c(Cr3+)降至10﹣5mol•L﹣1,溶液的pH应调至___ .

以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式
NaOH
(2)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=﹣574kJ•mol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=﹣1160kJ•mol﹣1
则甲烷直接将NO2还原为N2的热化学方程式为:
(3)某温度时,向AgNO3溶液中加入K2CrO4溶液会生成Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.

①该温度下,下列说法正确的是
| A.Ag2CrO4的溶度积常数(Ksp)为1×10﹣8 |
| B.含有大量CrO42-的溶液中一定不存在Ag+ |
| C.a点表示Ag2CrO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
| D.0.02mol•L﹣1的AgNO3溶液与0.02mol•L﹣1的Na2CrO4溶液等体积混合会生成沉淀 |
②若常温下Ksp[Cr(OH)3]=10﹣32,要使c(Cr3+)降至10﹣5mol•L﹣1,溶液的pH应调至
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网