解答题-原理综合题 适中0.65 引用1 组卷57
氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知32 g甲醇燃烧生成二氧化碳和液态水放出的热量为725. 76 kJ,若上述过程生成的水为气态,则放出的热量________ (填“大于”“小于”或“等于”) 725.76kJ。
(2)生产甲醇的原料 CO 和 H2来源于CH4(g)+H2O (g)⇌CO(g)+3H2(g)△H > 0,100℃时,将1 mol CH4和2 mol H2O通入容积为1L的定容密封容器中,发生上述反应。
①能说明该反应已达到平衡状态的是________ (填字母代号)。
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4的同时生成0.3mol H2
c.容器内的压强恒定
d.3v正(CH4) = v 逆(H2)
②如果反应开始至 5 min 后达到平衡 ,且平衡时CH4的转化率为 50%,则从开始到平衡这段时间内用比表示的反应速率为___________ 。
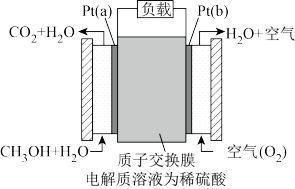
(3)近几年开发的甲醇燃料电池采用作铂电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理示意图如图所示:
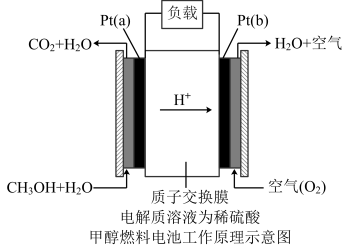
①P t (a)电极是电池的________ 极,电极反应式为_____________ 。
②如果该电池工作时电路中通过1.806×1023个电子,则消耗 CH3OH___ g。
(1)已知32 g甲醇燃烧生成二氧化碳和液态水放出的热量为725. 76 kJ,若上述过程生成的水为气态,则放出的热量
(2)生产甲醇的原料 CO 和 H2来源于CH4(g)+H2O (g)⇌CO(g)+3H2(g)△H > 0,100℃时,将1 mol CH4和2 mol H2O通入容积为1L的定容密封容器中,发生上述反应。
①能说明该反应已达到平衡状态的是
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4的同时生成0.3mol H2
c.容器内的压强恒定
d.3v正(CH4) = v 逆(H2)
②如果反应开始至 5 min 后达到平衡 ,且平衡时CH4的转化率为 50%,则从开始到平衡这段时间内用比表示的反应速率为
(3)近几年开发的甲醇燃料电池采用作铂电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理示意图如图所示:

①P t (a)电极是电池的
②如果该电池工作时电路中通过1.806×1023个电子,则消耗 CH3OH
19-20高一下·湖南·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网