I.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
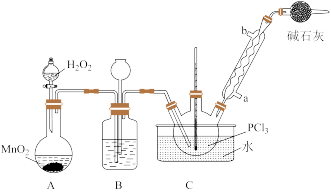
资料:① Ag+ + SCN- =AgSCN↓,Ksp(AgCl) >Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(2)B中所盛的试剂是
(3)POCl3遇水反应的化学方程式为
(4)反应温度要控制在60~65℃,原因是:
II.工业上可用氯化水解法生产三氯氧磷,工艺流程如下:
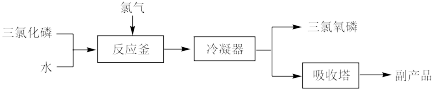
(5)氯化水解法生产三氯氧磷的化学方程式为
(6)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
a、准确称取30.7 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
b、取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2 mol·L-1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以X为指示剂,用0.2 mol·L-1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤c中加入硝基苯的作用是
②步骤d中X为
A FeCl2 B NH4Fe(SO4)2 C 淀粉 D 甲基橙
③三氯氧磷产品中Cl元素的质量百分含量为
三氯氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂。实验室制取POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。采用氧气氧化液态PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:
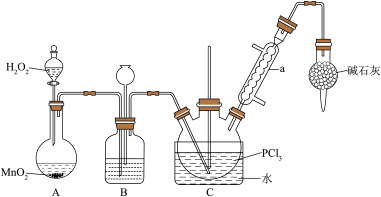
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体;遇水均剧烈水解为含氧酸和氯化氢;两者互溶。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为
(2)装置C中生成POCl3的化学方程式为
(3)装置B的作用除观察O2的流速之外,还有
(4)反应温度应控制在60-65℃之间,原因是
Ⅱ.测定POCl3产品的含量。
实验步骤:
①实验Ⅰ结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725gPOCl3,产品,置于盛60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL3.2mol·L-1AgNO3溶液,使氯离子完全沉淀;向其中加入少量硝基苯并用力摇动。
③以硫酸铁溶液为指示剂,用0.2 mol·L-1KSCN溶液滴定过量的AgNO3溶液,达滴定终点时共用去10.00mLKSCN溶液。
已知:Ag++SCN-=AgSCN↓;Ksp(AgCl)>Ksp(AgSCN)。
(5)达滴定终点时的现象为
(6)实验过程中加入硝基苯的目的是
(7)测得产品POCl3的百分含量为
已知:①KSCN+AgNO3=AgSCN↓+KNO3;
②Ksp(AgCl) > Ksp(AgSCN);
③磷酸银可溶于硝酸;
④PCl3和POCl3的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 性质 |
| PCl3 | -111.8 | 74.2 | 137.5 | 均为无色液体,遇水均剧烈水解,生成含氧酸和氯化氢,两者互溶。 |
| POCl3 | 2.0 | 105.3 | 153.5 |
Ⅰ.制备POCl3可用氧气氧化液态PCl3的方法。实验装置(加热及夹持装置省略)如下:
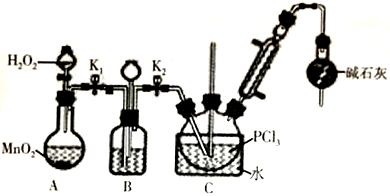
(1)装置C中盛装PCl3的仪器名称为
(2)仪器组装完成后,检查装置B气密性的方法是
(3)装置B的作用有
(4)装置C的反应温度控制在60-65℃之间,原因是
Ⅱ.测定产品中POCl3纯度的实验步骤:
①实验Ⅰ结束后,待反应器中液体冷却到室温,准确称取1.3300 g的POCl3粗产品(杂质不含氯元素),置于盛有50.00mL蒸馏水的烧杯中摇动至完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入30.00mL0.1200mol·L-1AgNO3标准溶液;
③加入少量硝基苯,用力摇动,静置;
④加入指示剂,用0.1000 mol·L-1KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去12.00mLKSCN溶液。
(5)滴定过程中选择的指示剂为
(6)步骤③的目的是
(7)测得产品中POCl3的纯度为
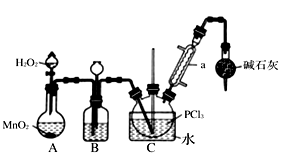
I.制备POCl3可用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略)及相关信息如下。
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其 他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(2)装置B中的液体药品是
(3)三氯化氧磷还可由三氯化磷与水、氯气反应制备。此方法生产三氯化氧磷的化学方程式为
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待反应器中液体冷却到室温,准确称取一定质量的 POCl3产品(杂质不含氯元素),置于盛有100.00 mL蒸馏水的烧杯中摇动至完全水解,将水解液配成200.00 mL溶液
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 1.5 mol/L AgNO3标准溶液
③加入少量硝基苯,用力摇动,静置
④加入指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去15.00 mL KSCN溶液。
(4)选择的指示剂为
(5)测得产品中n(POCl3)=
(6)已知Ksp(AgCl)> Ksp(AgSCN),步骤③的目的是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


