解答题-实验探究题 较难0.4 引用1 组卷73
已知:乙二酸(HOOC—COOH,可简写为H2C2O4),俗称草酸,157℃时开始分解。
(1)探究草酸的酸性
25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是___ 。
A.H2C2O4+ =
= +
+ B.
B. +
+ =
= +
+
C.2 +CO2+H2O=2
+CO2+H2O=2 +
+ D.H2C2O4+
D.H2C2O4+ =
= +H2O+CO2↑
+H2O+CO2↑
(2)探究草酸分解产物
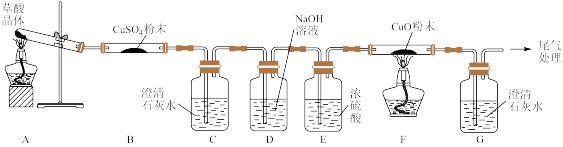
实验中观察到 B 中 CuSO4粉末变蓝,C 中澄清石灰水变浑浊,D 的作用是___ , 证明有 CO 气体生成的现象是______ 。
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入 4 mL 0.01 mol·L-1酸性 KMnO4溶液和 2 mL 0.1 mol·L-1H2C2O4溶液,再向乙试管中加入一粒黄豆大的 MnSO4固体,摇匀。填写表格:
(4)用酸性 KMnO4 溶液滴定 Na2C2O4,求算 Na2C2O4的纯度。
实验步骤:准确称取 2.0 g Na2C2O4固体,配成 100 mL 溶液;取出 20.00 mL 于锥形瓶 中,再向瓶中加入足量稀 H2SO4;用 0.016 0 mol·L-1 酸性 KMnO4溶液滴定,滴定至终点时消耗KMnO4溶液25.00 mL。
①KMnO4溶液应装在_________ 滴定管中。(填“酸式”或“碱式”)
②Na2C2O4的纯度是_________ 。
(1)探究草酸的酸性
25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是
A.H2C2O4+
C.2
(2)探究草酸分解产物

实验中观察到 B 中 CuSO4粉末变蓝,C 中澄清石灰水变浑浊,D 的作用是
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入 4 mL 0.01 mol·L-1酸性 KMnO4溶液和 2 mL 0.1 mol·L-1H2C2O4溶液,再向乙试管中加入一粒黄豆大的 MnSO4固体,摇匀。填写表格:
| 反应现象 | ① |
| 实验结论 | ② |
| 试管中发生反应的离子方程式 | ③ |
实验步骤:准确称取 2.0 g Na2C2O4固体,配成 100 mL 溶液;取出 20.00 mL 于锥形瓶 中,再向瓶中加入足量稀 H2SO4;用 0.016 0 mol·L-1 酸性 KMnO4溶液滴定,滴定至终点时消耗KMnO4溶液25.00 mL。
①KMnO4溶液应装在
②Na2C2O4的纯度是
19-20高二下·四川内江·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


