(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4kJ·mol-1
2NO2(g)=N2O4(g) △H2=-55.3kJ·mol-1
则反应:2N2O5(g)=4NO2(g)+O2(g)的△H=
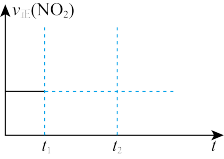
(2)对于反应2N2O5(g)⇌4NO2(g)+O2(g),在恒容密闭容器中反应达到平衡。t1时充入N2O5(g),t2时又达到平衡,在下图中画出v正(NO2)随时间变化的趋势图
有人提出如下反应历程:
第一步.N2O5(g)⇌NO2(g)+NO3(g) 快速平衡:
第二步NO2+NO3→NO+NO2+O2 慢反应;
第三步NO+NO3→2NO2 快反应。
其中可近似认为第二步反应不影响第一步的平衡,下列表述正确的是
A.v(第一步的逆反应)<v(第二步反应) B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高
(3)NO2存在如下平衡:2NO2(g)⇌N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压x物质的量分数)有如下关系:v(NO2)=k1·p2(NO2);v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
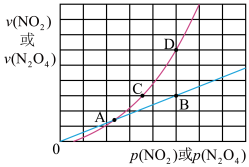
一定温度下, k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是K1=
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理和化学平衡对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。

请回答下列问题:
①写出反应II的热化学方程式
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)2NO2(g)反应速率的是
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
浓度(mol·L-1) 时间(min) | NO | CO2 | N2 |
0 | 0.200 | 0 | 0 |
12 | 0.050 | 0.075 | 0.075 |
15 | 0.100 | 0.050 | 0.450 |
①T℃时,该反应的平衡常数为
②在12min时,若只改变某一条件使平衡发生移动,15min时重新达到平衡,则改变的条件是
③在15min时,保持温度和容器体积不变再充入NO和N2,使NO、N2的浓度分别增加至原来的2倍4倍,此时反应v正
(3)NO2存在如下平衡:2NO2(g)N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=
(1)已知:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
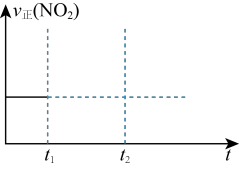
(2)①对于反应2N2O5(g)
第一步N2O5(g)
第二步NO2(g)+NO3→NO+NO2+O2慢反应;
第三步NO+NO3→2NO2快反应
其中可近似认为第二步反应不影响第一步的平衡,一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,下列表述正确的是
A.υ(第一步的逆反应)<υ(第二步反应)
B.反应的中间产物只有NO3
C.容器中压强不再变化能说明反应已达平衡
D.气体的密度保持不变能说明反应已达平衡
②对于反应2N2O5(g)
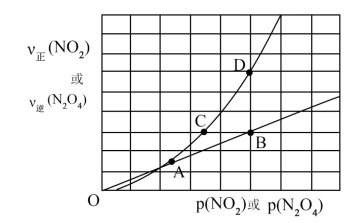
(3)NO2存在如下平衡:
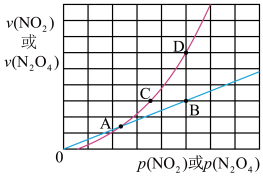
在图上标示的各点中,表示反应已达到平衡状态的点是
(4)

(1)NO在空气中存在如下反应:2NO(g)+O2(g)
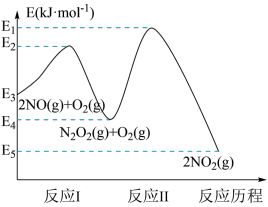
反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)
| 浓度 时间 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.040 | 0.030 | 0.030 |
| 20 | 0.032 | 0.034 | 0.017 |
①在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是
②在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正
(3)NO2存在如下平衡:2NO2(g)
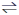 N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


