解答题-结构与性质 0.4 引用1 组卷74
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是__ (填元素符号),e的价层电子轨道示意图为__ 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为___ ;分子中既含有极性共价键,又含有非极性共价键的化合物是___ (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是__ ;酸根呈三角锥结构的酸是___ 。(填化学式)
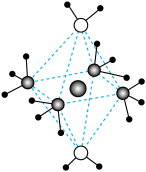
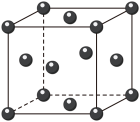
(4)e和c形成的一种离子化合物的晶体结构如图,则e离子的电荷为__ 。__ ,阳离子中存在的化学键类型有__ ;该化合物加热时首先失去的组分是__ ,判断理由是___ 。________ ;e的原子半径为________ cm(阿伏加 德罗常数为NA,要求列式,下同)。晶胞中原子的体积占晶胞体积的百分率为__________ 。
(1)b、c、d中第一电离能最大的是
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是
(4)e和c形成的一种离子化合物的晶体结构如图,则e离子的电荷为

19-20高二下·吉林长春·阶段练习


