解答题-原理综合题 适中0.65 引用1 组卷99
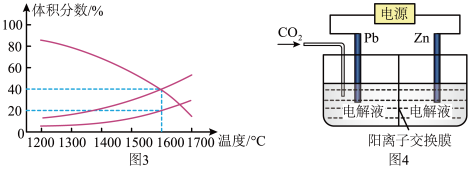
工业上利用CO2和H2反应生成甲醇,也是减少CO2的一种方法。在容积为 1L 的恒温密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示:

(1)达到平衡的时刻是_________ min(填“3”或“10”)。在前10min内,用CO2浓度的变化表示的反应速率υ(CO2)=_________ mol/(L· min)。
(2)能判断该反应达到化学平衡状态的依据是_________ 。
a.容器内压强不变 b.混合气体中c(CO2)不变 c.υ(CH3OH)=υ(H2O) d.c(CH3OH)=c(H2O)
(3)达平衡后,H2的转化率是_________ 。平衡常数 K =_________ (计算结果保留一位小数)。为了提高H2的转化率,可采取_________ (填“增大”或“减小”)CO2浓度的措施。
(4)工业上也可用 CO 和H2合成甲醇
已知:①CO(g) + O2(g) = CO2(g) △H1=-283.0 kJ/mol
O2(g) = CO2(g) △H1=-283.0 kJ/mol
②H2(g) + O2(g) = H2O(g) △H2=-241.8 kJ/mol
O2(g) = H2O(g) △H2=-241.8 kJ/mol
③CH3OH(g) + O2(g) = CO2(g)+2H2O(g) △H3=-673kJ/mol
O2(g) = CO2(g)+2H2O(g) △H3=-673kJ/mol
则反应CO(g) + 2H2(g) = CH3OH(g)△H=_________ kJ/mol
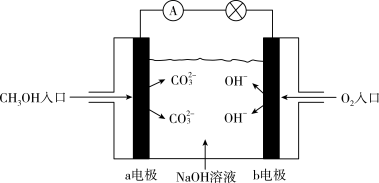
(5)如图是甲醇燃料电池原理示意图,电池正极的电极反应式为:_________ 。

(1)达到平衡的时刻是
(2)能判断该反应达到化学平衡状态的依据是
a.容器内压强不变 b.混合气体中c(CO2)不变 c.υ(CH3OH)=υ(H2O) d.c(CH3OH)=c(H2O)
(3)达平衡后,H2的转化率是
(4)工业上也可用 CO 和H2合成甲醇
已知:①CO(g) +
②H2(g) +
③CH3OH(g) +
则反应CO(g) + 2H2(g) = CH3OH(g)△H=
(5)如图是甲醇燃料电池原理示意图,电池正极的电极反应式为:

19-20高二下·北京丰台·期末
类题推荐
工业上利用CO2和H2反应生成甲醇,也是减少CO2的一种方法。在容积为1 L的恒温恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到10分钟平衡,用CO2浓度的变化表示的反应速率v(CO2)=_______ mol/(L·min)。
(2)能判断该反应达到化学平衡状态的依据是_______。
(3)求该反应的平衡常数表达式K=_______ 。达平衡后,H2的转化率是_______ 。
(4)工业上也可用CO和H2合成甲醇
已知:①CO(g)+ O2(g)=CO2(g) △H1=-283.0 kJ/mol
O2(g)=CO2(g) △H1=-283.0 kJ/mol
②H2(g)+ O2(g)=H2O(g) △H2=-241.8 kJ/mol
O2(g)=H2O(g) △H2=-241.8 kJ/mol
③CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) △H3=-192.2 kJ/mol
O2(g)=CO2(g)+2H2O(g) △H3=-192.2 kJ/mol
则反应CO(g)+2H2(g)=CH3OH(g) △H=_______ kJ/mol
(5)环戊二烯( )容易发生聚合生成二聚体,该反应为可逆反应。不同温度T1、T2下,溶液中环戊二烯浓度与反应时间的关系如图所示。回答下列问题:
)容易发生聚合生成二聚体,该反应为可逆反应。不同温度T1、T2下,溶液中环戊二烯浓度与反应时间的关系如图所示。回答下列问题:

①比较b、c处反应速率大小:v(b)_______ v(c) (填“大于”“小于”或“等于”)。
②比较反应温度T1、T2的大小:T1_______ T2 (填“大于”“小于”或“等于”)。

(1)从反应开始到10分钟平衡,用CO2浓度的变化表示的反应速率v(CO2)=
(2)能判断该反应达到化学平衡状态的依据是_______。
| A.容器内压强不变 | B.混合气体中c(CO2)不变 |
| C.v(CH3OH)=v(H2O) | D.混合气体的密度不变 |
(4)工业上也可用CO和H2合成甲醇
已知:①CO(g)+
②H2(g)+
③CH3OH(g)+
则反应CO(g)+2H2(g)=CH3OH(g) △H=
(5)环戊二烯(
 )容易发生聚合生成二聚体,该反应为可逆反应。不同温度T1、T2下,溶液中环戊二烯浓度与反应时间的关系如图所示。回答下列问题:
)容易发生聚合生成二聚体,该反应为可逆反应。不同温度T1、T2下,溶液中环戊二烯浓度与反应时间的关系如图所示。回答下列问题:
①比较b、c处反应速率大小:v(b)
②比较反应温度T1、T2的大小:T1
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH(g)+H2O(g) △H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
CH3OH(g)+H2O(g) △H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
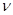 (CO2)=
(CO2)=