解答题-原理综合题 适中0.65 引用1 组卷189
CO2的综合利用对温室气体的减排以及对减缓燃料危机等具有重要意义。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH=111kJ·mol-1
O2(g)=CO(g) ΔH=111kJ·mol-1
该催化重整反应的ΔH=____ kJ·mol-1。
(2)CH4-CO2催化重整反应通过热力学计算可得到的图象之一如图。
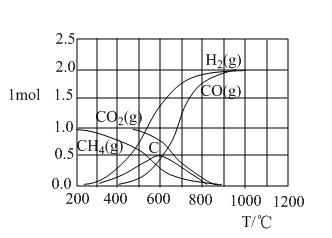
①200—400℃时,主要发生的反应的化学方程式为___ 。
②当温度高于600℃时,随着温度的升高C的物质的量减少,其原因是__ (用文字表达)。
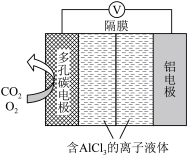
(3)辅助的Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
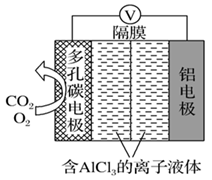
电池的正极反应式:6O2+6e-=6O2-,6CO2+6O2-=3C2O +6O2。
+6O2。
反应过程中O2的作用是___ 。电池的负极反应式为___ 。
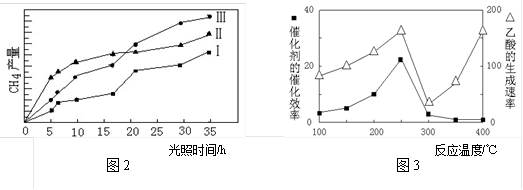
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如题图所示。
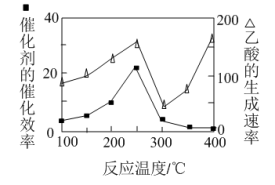
①Cu2Al2O4可溶于稀硝酸,该反应的离子方程式为___ 。
②300~400℃时,乙酸的生成速率升高的原因是____ 。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
C(s)+
该催化重整反应的ΔH=
(2)CH4-CO2催化重整反应通过热力学计算可得到的图象之一如图。

①200—400℃时,主要发生的反应的化学方程式为
②当温度高于600℃时,随着温度的升高C的物质的量减少,其原因是
(3)辅助的Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。

电池的正极反应式:6O2+6e-=6O2-,6CO2+6O2-=3C2O
反应过程中O2的作用是
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如题图所示。

①Cu2Al2O4可溶于稀硝酸,该反应的离子方程式为
②300~400℃时,乙酸的生成速率升高的原因是
2020·江苏·模拟预测
类题推荐
CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
则该反应的△H=____ 。
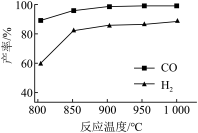
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900℃的原因是______ 。

(2)O2辅助的A1-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
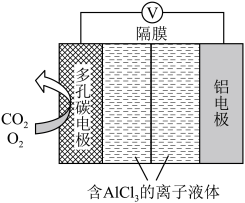
电池的负极反应式:_____ 。
电池的正极反应式:6O2+6e-=6O2- ;6CO2+6O2-=3C2O +6O2
+6O2
反应过程中O2的作用是_____ 。该电池的总反应式:_____ 。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C-H | C=O | H-H | C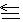 O(CO) O(CO) |
| 键能/kJ⋅mol-1 | 413 | 745 | 436 | 1075 |
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900℃的原因是

(2)O2辅助的A1-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。

电池的负极反应式:
电池的正极反应式:6O2+6e-=6O2- ;6CO2+6O2-=3C2O
反应过程中O2的作用是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网