解答题-实验探究题 适中0.65 引用2 组卷448
某校化学小组同学研究 Cu与H2SO4 溶液反应,小伟同学实验记录如下:
(1)实验一:探究白雾的成分
①波波同学收集实验Ⅰ中白雾,加入品红溶液,溶液褪色,得出结论:白雾成分包含 SO2。可能是因为局部温度过高产生,写出有关化学方程式________ 。
②艳艳同学认为不妥,补充实验Ⅲ:
根据实验Ⅲ,可推断白雾成分是______ ,而并非SO2。
(2)实验二:探究红色固体的成分。经过分析,实验Ⅰ和实验Ⅱ中的红色浑浊成分相同。
【资料】Cu2O能溶在浓氨水中形成无色Cu(NH3)2+,很容易被氧气氧化为蓝色Cu(NH3)22+;Cu2O能与一定浓度的酸溶液发生反应:Cu2O+2H+=Cu2++Cu+H2O。
①写出Cu2O溶在浓氨水中的离子方程式_______ 。
②对于红色浑浊的成分,谷哥设计实验并实施,证实了红色固体中只有Cu2O。他的实验是:将实验Ⅰ试管中固体过滤洗涤,得红色固体,__________ 。
③结合实验Ⅰ和Ⅱ,吉吉同学确定铜丝烧至红热时生成了______ 。
(3)实验三:探究红色固体不溶的原因。经过检验,实验Ⅰ和实验Ⅱ反应后的溶液均显酸性,对于体系中有Cu2O固体的原因:
龙校假设:在实验条件下,随着溶液酸性降低,Cu2O与酸无法反应。
乔博假设:在实验条件下,随着溶液酸性降低,Cu2O与酸反应速率变小。
邹邹同学继续实验:
①实验Ⅴ的目的是 ______ 。
②通过以上实验,臧臧同学得出的结论是______ 。
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 取螺旋状铜丝在酒精灯上烧至红热,迅速伸入装有 10 mL 3 mol/L H2SO4溶液的试管中 | 产生大量白雾;溶液颜色变为浅蓝色;试管中出现红色浑浊 |
| Ⅱ | 步骤一:取螺旋状铜丝在酒精灯上烧至红热, 迅速伸入装有10 mL蒸馏水的试管中; 步骤二:冷却后加入5 mL 3 mol/L H2SO4 | 步骤一:产生少量白雾;试管中出现黑色浑浊,略带红色 步骤二:浑浊全部为红色;溶液略显蓝色 |
①波波同学收集实验Ⅰ中白雾,加入品红溶液,溶液褪色,得出结论:白雾成分包含 SO2。可能是因为局部温度过高产生,写出有关化学方程式
②艳艳同学认为不妥,补充实验Ⅲ:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅲ | 步骤一:取品红溶液,加 3 mol/L H2SO4溶液,加热; 步骤二:收集实验Ⅰ中白雾,加入品红溶液,加热 | 步骤一:溶液褪色,加热无颜色变化; 步骤二:溶液褪色,加热无颜色变化 |
(2)实验二:探究红色固体的成分。经过分析,实验Ⅰ和实验Ⅱ中的红色浑浊成分相同。
【资料】Cu2O能溶在浓氨水中形成无色Cu(NH3)2+,很容易被氧气氧化为蓝色Cu(NH3)22+;Cu2O能与一定浓度的酸溶液发生反应:Cu2O+2H+=Cu2++Cu+H2O。
①写出Cu2O溶在浓氨水中的离子方程式
②对于红色浑浊的成分,谷哥设计实验并实施,证实了红色固体中只有Cu2O。他的实验是:将实验Ⅰ试管中固体过滤洗涤,得红色固体,
③结合实验Ⅰ和Ⅱ,吉吉同学确定铜丝烧至红热时生成了
(3)实验三:探究红色固体不溶的原因。经过检验,实验Ⅰ和实验Ⅱ反应后的溶液均显酸性,对于体系中有Cu2O固体的原因:
龙校假设:在实验条件下,随着溶液酸性降低,Cu2O与酸无法反应。
乔博假设:在实验条件下,随着溶液酸性降低,Cu2O与酸反应速率变小。
邹邹同学继续实验:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅳ | 取Cu2O固体少量,加入到装有 10 mL3 mol/L H2SO4 溶液的试管中 | 溶液迅速变为蓝色;试管中出现少量亮红色固体 |
| Ⅴ | 取Cu2O固体少量,加入到装有 10 mL 3 mol/L H2SO4 和少量CuSO4 (浅蓝色)的试管中 | 现象同Ⅳ |
| Ⅵ | 重复实验Ⅰ,振荡试管,分为两等份。第一份立刻加入浓硫酸至 c(H2SO4)=3 mol/L;第二份静置 4 h之后,过滤,向固体中加入浓硫酸至 c(H2SO4)=3 mol/L | 第一份加酸后红色固体明显减少,溶液蓝色加深;第二份静置时,固体减少,溶液缓慢变为蓝色,固体加酸后无明显现象。 |
②通过以上实验,臧臧同学得出的结论是
2020·北京海淀·三模
类题推荐
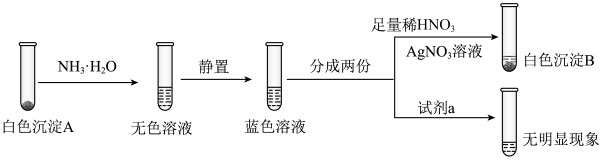
我校某同学为探究不同金属阳离子与碘离子的反应进行了如下实验:分别取2ml0.1 硫酸铜,氯化铁,硝酸银溶液于试管,各试管中分别滴加2ml0.1
硫酸铜,氯化铁,硝酸银溶液于试管,各试管中分别滴加2ml0.1 碘化钾溶液。
碘化钾溶液。
观察到现象如下:
硝酸银溶液中出现黄色沉淀,硫酸铜溶液中出现白色沉淀,溶液呈现棕黄色,氯化铁溶液中无沉淀生成,溶液呈棕红色。
为进一步探究产物,继续分别向三支试管中加入1ml四氯化碳,充分振荡后静止,
实验现象如下:
原硝酸银溶液的试管中溶液分层,下层为无色,原硫酸铜试管中溶液分层,下层为紫红色,原氯化铁溶液试管中溶液分层,下层为紫红色。
(1)请根据以上实验现象,依次写出硝酸银溶液,硫酸铜溶液,氯化铁溶液中滴加碘化钾的离子反应方程式:_______________ ,_________________ ,_______________ 。
资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。已知:I2易溶于KI溶液,发生反应I2+I-
 (红棕色);I2和
(红棕色);I2和 氧化性几乎相同。
氧化性几乎相同。
将等体积的KI溶液加入到m mol铜粉和nmol I2(n>m)的固体混合物中,振荡。实验记录如下:
①初始阶段,Cu被氧化的反应速率:实验I______ 实验Ⅱ(填“>”、“<”或“=”)。
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。
i.步骤a的目的是_______________ 。
ii.查阅资料,[Cu(NH3)2]+(无色)容易被空气氧化。
结合资料和前面同学所做实验中硫酸铜和碘化钾的反应方程式,用离子方程式释步骤b的溶液中发生的变化:______________ 。
③结合实验Ⅲ,推测实验I和Ⅱ中的白色沉淀可能是CuI,实验I中铜被氧化的化学方程式是____________ 。分别取实验I和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液,_____________ (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是___________ 。
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是________________ 。
观察到现象如下:
硝酸银溶液中出现黄色沉淀,硫酸铜溶液中出现白色沉淀,溶液呈现棕黄色,氯化铁溶液中无沉淀生成,溶液呈棕红色。
为进一步探究产物,继续分别向三支试管中加入1ml四氯化碳,充分振荡后静止,
实验现象如下:
原硝酸银溶液的试管中溶液分层,下层为无色,原硫酸铜试管中溶液分层,下层为紫红色,原氯化铁溶液试管中溶液分层,下层为紫红色。
(1)请根据以上实验现象,依次写出硝酸银溶液,硫酸铜溶液,氯化铁溶液中滴加碘化钾的离子反应方程式:
资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。已知:I2易溶于KI溶液,发生反应I2+I-
将等体积的KI溶液加入到m mol铜粉和nmol I2(n>m)的固体混合物中,振荡。实验记录如下:
c(KI) | 实验现象 | |
| 实验I | 0.01 | 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色。 |
| 实验Ⅱ | 0.1 | 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色。 |
| 实验Ⅲ | 4 | I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色。 |
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。
i.步骤a的目的是
ii.查阅资料,[Cu(NH3)2]+(无色)容易被空气氧化。
结合资料和前面同学所做实验中硫酸铜和碘化钾的反应方程式,用离子方程式释步骤b的溶液中发生的变化:
③结合实验Ⅲ,推测实验I和Ⅱ中的白色沉淀可能是CuI,实验I中铜被氧化的化学方程式是
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是

草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:___________ 。
(2)实验Ⅰ试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为__________ 。
(3)瑛瑛和超超查阅资料,实验Ⅰ试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验Ⅳ的目的是:_______________ 。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72-浓度变化如图:
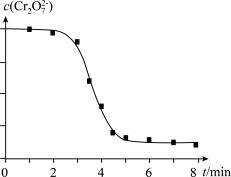
臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i:MnO2与H2C2O4反应生成了Mn2+。
过程ii:___________ 。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001mol MnO2加入到6mL______ 中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到________________ 。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案如下:将2mL、0.3mol/LH2C2O4溶液与4mL0.01mol/LK2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体,6分钟后现象为:______________
(5)综合以上实验可知,草酸发生氧化反应的速率与____________ 有关。
| 实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1 h后溶液) | ||
| 试管 | 滴管 | ||||
 | a | 4mL0.01mol•L-1KMnO4溶液,几滴浓H2SO4 | 2 mL0.3mol•L-1 H2C2O4溶液 | 2 | 褪为无色 |
| b | 4mL0.01mol•L-1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
| c | 4mL0.01mol•L-1K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
| d | 4mL0.01mol•L-1K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(2)实验Ⅰ试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为
(3)瑛瑛和超超查阅资料,实验Ⅰ试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
| 实验Ⅱ | 实验Ⅲ | 实验Ⅳ | |
| 实验 操作 | 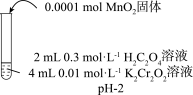 |  |  |
| 实验 现象 | 6 min后固体完全溶解,溶液橙色变浅,温度不变 | 6 min后固体未溶解,溶液颜色无明显变化 | 6 min后固体未溶解,溶液颜色无明显变化 |
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72-浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i:MnO2与H2C2O4反应生成了Mn2+。
过程ii:
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001mol MnO2加入到6mL
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案如下:将2mL、0.3mol/LH2C2O4溶液与4mL0.01mol/LK2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体,6分钟后现象为:
(5)综合以上实验可知,草酸发生氧化反应的速率与
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网