解答题-原理综合题 适中0.65 引用1 组卷58
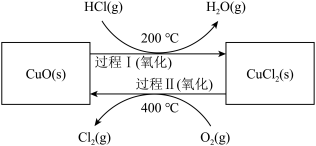
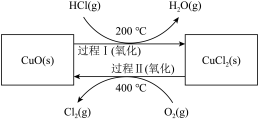
氯气是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
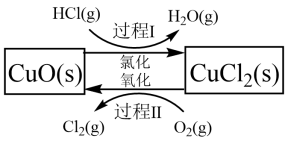
过程 I 的反应为, 2HCl(g)+CuO(s) CuCl2(s)+H2O(g)△H= -132kJ/mol
CuCl2(s)+H2O(g)△H= -132kJ/mol
(1)该原理中起到催化剂作用物质的化学式为_______________________ ;
(2)过程 II 反应的热化学方程式为____________________ ;
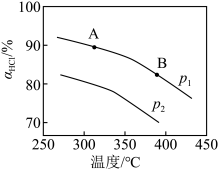
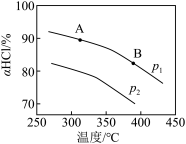
(3)压强为p1时,地康法中HCl 的平衡转化率aHCl 随温度变化曲线如图。
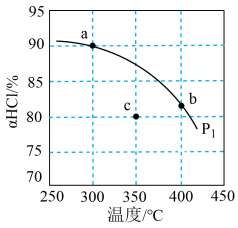
①比较 a、b 两点的平衡常数大小 K(a)=_______________ K(b)(填“>”“<”或“=”),解释原因为________________ ;
②c 点表示投料不变, 350℃、压强为p2时,地康法中HCl 的平衡转化率,则p2_________________ p1(填“>”“<”或“=”)。

过程 I 的反应为, 2HCl(g)+CuO(s)
(1)该原理中起到催化剂作用物质的化学式为
(2)过程 II 反应的热化学方程式为
(3)压强为p1时,地康法中HCl 的平衡转化率aHCl 随温度变化曲线如图。

①比较 a、b 两点的平衡常数大小 K(a)=
②c 点表示投料不变, 350℃、压强为p2时,地康法中HCl 的平衡转化率,则p2
19-20高二下·北京海淀·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网