解答题-原理综合题 较难0.4 引用1 组卷71
.按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)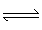 NH2COONH4(s)△H1
NH2COONH4(s)△H1
反应Ⅱ:NH2COONH4(s)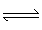 CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)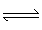 CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
①反应Ⅰ的△H1=__ 。
②一定温度下,在体积固定的密闭容器中按n(NH3):n(CO2)=2:1进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是__ (填序号)。
A.容器内气体总压强不再变化
B.NH3与CO2的转化率相等
C.容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)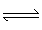 CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
回答下列问题:
①该反应的化学平衡常数表达式为K=__ 。
②该反应为__ (填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为__ ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,此时反应向__ (填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO (aq)
(aq)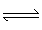 PbCO3(s)+SO
PbCO3(s)+SO ( aq)。
( aq)。
已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K=__ 。
Ⅱ.N2H4—O2燃料电池是一种高效低污染的新型电池,其装置如图所示:
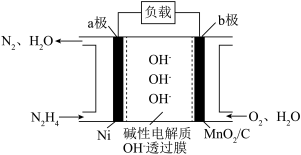
(1)N2H4的电子式为__ ;
(2)a极的电极反应方程式为___ 。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)
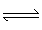 NH2COONH4(s)△H1
NH2COONH4(s)△H1反应Ⅱ:NH2COONH4(s)
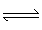 CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol总反应:2NH3(g)+CO2(g)
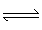 CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol①反应Ⅰ的△H1=
②一定温度下,在体积固定的密闭容器中按n(NH3):n(CO2)=2:1进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是
A.容器内气体总压强不再变化
B.NH3与CO2的转化率相等
C.容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)
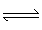 CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=
②该反应为
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,此时反应向
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO
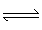 PbCO3(s)+SO
PbCO3(s)+SO已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K=
Ⅱ.N2H4—O2燃料电池是一种高效低污染的新型电池,其装置如图所示:

(1)N2H4的电子式为
(2)a极的电极反应方程式为
19-20高二下·广西百色·阶段练习
类题推荐
I.已知在448 ℃时,反应H2(g)+I2(g)⇌2HI(g)的平衡常数K1为49。
(1)该温度下反应2HI(g)⇌H2(g)+I2(g)的平衡常数K2为_______ ;反应 H2(g)+
H2(g)+ I2(g)⇌HI(g)的平衡常数K3为
I2(g)⇌HI(g)的平衡常数K3为_______ 。
Ⅱ.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
回答下列问题:
(2)该反应的化学平衡常数表达式为K=_______ 。
(3)该反应为_______ (填“吸热”或“放热”)反应。
(4)能判断该反应达到化学平衡状态的依据是_______。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______ ℃。
(6)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将_______ (填“正向”或“逆向”)进行。
III.已知工业上合成氨的反应原理为:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92 kJ·mol-1。
(7)要提高生成物中NH3的体积分数,适宜的生产条件是_______ 。
(1)该温度下反应2HI(g)⇌H2(g)+I2(g)的平衡常数K2为
Ⅱ.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(2)该反应的化学平衡常数表达式为K=
(3)该反应为
(4)能判断该反应达到化学平衡状态的依据是_______。
| A.容器中压强不变 | B.混合气体中c(CO)不变 |
| C.v正(H2)=v逆(H2O) | D.c(CO2)=c(CO) |
(6)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将
III.已知工业上合成氨的反应原理为:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92 kJ·mol-1。
(7)要提高生成物中NH3的体积分数,适宜的生产条件是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网