解答题-实验探究题 适中0.65 引用2 组卷143
碘化钠在医疗及食品方面有重要作用。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4·H2O+NaCl+Na2CO3
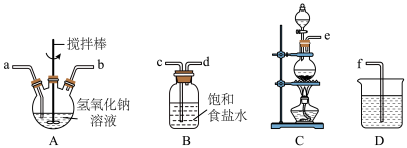
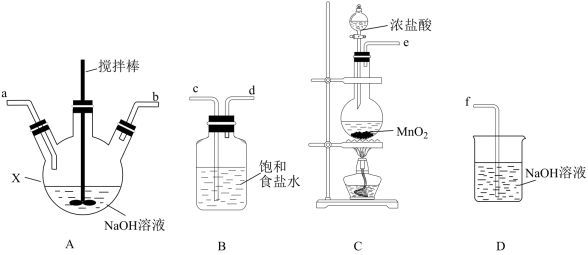
①制备次氯酸钠和氢氧化钠混合液装置的连接顺序为________________ (按气流方向用小写字母表示)。
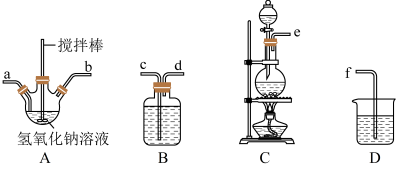
②若该实验温度控制不当,反应后测得三颈烧瓶内ClO-与ClO3-的物质的量之比为1:5,则Cl2与NaOH反应时,被氧化的氯元素与被还原的氯元素物质的量之比为_______________ 。
③制备水合肼时,应将_____________________ 滴到 ________________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
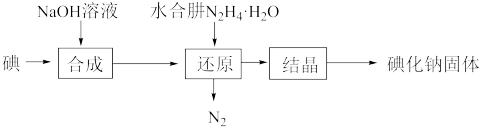
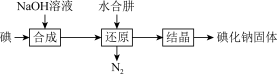
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
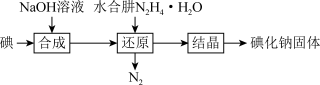
在“还原”过程中,主要消耗反应过程中生成的副产物IO ,该过程的化学方程式为
,该过程的化学方程式为 _______________________________________________ 。
工业上也可用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是___________________________________________________________________________________ 。
(3)测定产品中碘化钠含量的实验步骤
a、称取10.00g样品并溶解,在250mL容量瓶中定容;
b、量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后再加入X溶液作指示剂;
c、用0.2100mol·L-1的Na2S2O3标准液滴定至终点(2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准液体积为15.00mL。
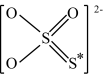
①S2O 的结构式如图所示,其中S*的化合价为
的结构式如图所示,其中S*的化合价为____________ 。
②X溶液为___________ ;滴定终点的现象为 __________________ 。
③该样品中NaI的质量分数为_________ 。
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4·H2O+NaCl+Na2CO3
①制备次氯酸钠和氢氧化钠混合液装置的连接顺序为

②若该实验温度控制不当,反应后测得三颈烧瓶内ClO-与ClO3-的物质的量之比为1:5,则Cl2与NaOH反应时,被氧化的氯元素与被还原的氯元素物质的量之比为
③制备水合肼时,应将
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:

在“还原”过程中,主要消耗反应过程中生成的副产物IO
工业上也可用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是
(3)测定产品中碘化钠含量的实验步骤
a、称取10.00g样品并溶解,在250mL容量瓶中定容;
b、量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后再加入X溶液作指示剂;
c、用0.2100mol·L-1的Na2S2O3标准液滴定至终点(2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准液体积为15.00mL。
①S2O

②X溶液为
③该样品中NaI的质量分数为
19-20高三下·辽宁盘锦·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网