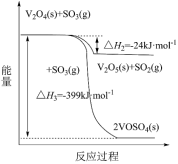
解答题-原理综合题 适中0.65 引用2 组卷142
二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+ O2(g)=2CO(g)+3H2(g)△H
O2(g)=2CO(g)+3H2(g)△H
已知:CH3OCH3(g) CO(g)+H2(g)+CH4(g)△H1
CO(g)+H2(g)+CH4(g)△H1
CH4(g)+ O2(g)=CO(g)+2H2O (g)△H2
O2(g)=CO(g)+2H2O (g)△H2
H2(g)+ O2(g)=H2O (g)△H3
O2(g)=H2O (g)△H3
①则反应I的△H=____________________ (用含△H1、△H2、△H3的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当 >0.6时,H2的体积百分含量快速降低,其主要原因是
>0.6时,H2的体积百分含量快速降低,其主要原因是____ (填标号)。

A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C. >0.6平衡向逆反应方向移动
>0.6平衡向逆反应方向移动
(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g) CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
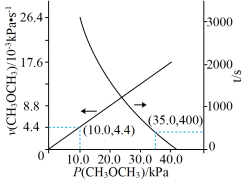
①t=400 s时,CH3OCH3的转化率为________ (保留2位有效数字);反应速率满足v(CH3OCH3)=kPn(CH3OCH3),k=_________ s-1;400 s时v(CH3OCH3)=_________ kPa∙s-1。
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=________________ kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是________ 。
(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+
已知:CH3OCH3(g)
CH4(g)+
H2(g)+
①则反应I的△H=
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当

A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C.
(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g)

①t=400 s时,CH3OCH3的转化率为
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是
2020·陕西安康·模拟预测
类题推荐
二甲醚可用于护发、护肤药品和涂料中作各类气雾推进剂。在制药、染料、农药等工业中有许多独特的用途。
(1)已知:CO(g)、H2(g)、CH3OCH3(g)的燃烧热ΔH分别为-283kJ·mol-1、-285.8kJ·mol-1、-1460kJ·mol-1,H2O(g)=H2O(l) ΔH1=-44 kJ·mol-1。则2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH2=_______ ,该反应能否自发进行与_______ 有关。
(2)T1 ℃时,在恒容密闭容器中通入CH3OCH3 ,发生反应CH3OCH3(g)⇌CO(g)+H2(g) +CH4(g) ,测得容器内初始压强为50kPa,反应过程中反应时间t与气体总压p总的关系如下表所示。
①该温度下,反应达到平衡时,CH3OCH3的分解率为_______ ;t=350s时,混合气体的平均摩尔质量为_______ (保留三位有效数字)g·mol-1。
②若反应达到平衡后,升高温度,CH3OCH3的浓度增大,则正反应为_______ (填“放热”或“吸热”)反应。
③该温度下,要缩短反应达到平衡所需的时间,可采取的措施是_______ 。
(3)在T2℃、p0kPa(恒温、恒压)下,将等物质的量的CO与H2通入容积为VL的容器内,发生反应:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)。反应达到平衡时,测得容器容积为0.6VL,用气体分压[气体分压(p)=气体总压(p总)×体积分数]代替平衡浓度表示的平衡常数Kp=_______ (kPa)-4。反应速率v=v正-v逆=k正p2(CO)·p4(H2)-k逆p(CH3OCH3)p(H2O),k正、k逆分别为正、逆反应速率常数,p为气体的分压。该温度下,当容器体积为0.8VL时, =
=_______ 。
(1)已知:CO(g)、H2(g)、CH3OCH3(g)的燃烧热ΔH分别为-283kJ·mol-1、-285.8kJ·mol-1、-1460kJ·mol-1,H2O(g)=H2O(l) ΔH1=-44 kJ·mol-1。则2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH2=
(2)T1 ℃时,在恒容密闭容器中通入CH3OCH3 ,发生反应CH3OCH3(g)⇌CO(g)+H2(g) +CH4(g) ,测得容器内初始压强为50kPa,反应过程中反应时间t与气体总压p总的关系如下表所示。
| 反应时间t/s | 0 | 100 | 350 | 850 | 2000 | 2500 |
| 气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 125.0 | 125.0 |
②若反应达到平衡后,升高温度,CH3OCH3的浓度增大,则正反应为
③该温度下,要缩短反应达到平衡所需的时间,可采取的措施是
(3)在T2℃、p0kPa(恒温、恒压)下,将等物质的量的CO与H2通入容积为VL的容器内,发生反应:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)。反应达到平衡时,测得容器容积为0.6VL,用气体分压[气体分压(p)=气体总压(p总)×体积分数]代替平衡浓度表示的平衡常数Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网