解答题-结构与性质 适中0.65 引用2 组卷270
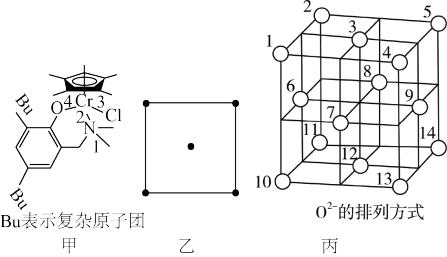
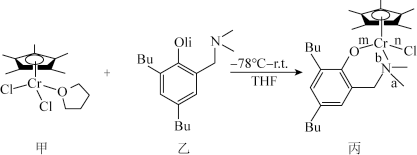
我国化学家合成的铬的化合物,通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现出较好的催化活性。合成铭的化合物过程中一步反应如下,该反应涉及H、C、N、O、Cl、Cr等多种元素。
回答下列问题:
(1)下列状态的氯中,电离最外层一个电子所需能量最大的是_____________ (填标号)。
A.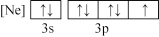 B.
B.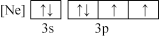
C. D.
D.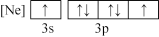
(2)化合物乙中碳原子采取的杂化方式为______ ,化合物丙中a、b、n、m处的化学键是配位键的是______ (填字母)处。
(3)Cr3+具有较强的稳定性,Cr3+的核外电子排布式为______ ;已知没有未成对d电子的过渡金属离子形成的水合离子是无色的,Ti4+、V3+、Ni2+三种离子的水合离子为无颜色的是______ (填离子符号)。
(4)ClO3-的键角小于ClO4-的键角,原因是______ 。
(5)根据结构与性质的关系解释,HNO2的酸性比HNO3弱的原因:______ 。
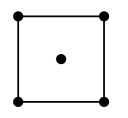
(6)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y、z轴的投影图如图所示,晶体中的H2O配位数为_____ 晶胞边长为a pm,则重冰的密度为____ g·cm-3(写出数学表达式,NA为阿伏加 德罗常数)。
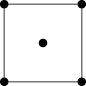

回答下列问题:
(1)下列状态的氯中,电离最外层一个电子所需能量最大的是
A.
 B.
B.
C.
 D.
D.
(2)化合物乙中碳原子采取的杂化方式为
(3)Cr3+具有较强的稳定性,Cr3+的核外电子排布式为
(4)ClO3-的键角小于ClO4-的键角,原因是
(5)根据结构与性质的关系解释,HNO2的酸性比HNO3弱的原因:
(6)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y、z轴的投影图如图所示,晶体中的H2O配位数为

2020·安徽·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为