填空题 适中0.65 引用1 组卷397
常温下,部分酸的电离平衡常数如下:
(1)c(H+)相同的三种酸溶液的浓度从大到小为___ 。
(2)若HCN溶液的起始浓度为0.01mol·L-1,平衡时c(H+)约为__ mol·L-1。使此溶液中HCN的电离程度增大且c(H+)也增大的方法是__ 。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a__ (填“大于”“小于”或“等于”,下同)b。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1__ n2。
(4)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为__ 。
(5)设计实验证明氢氟酸比HCl的酸性弱__ 。
| 化学式 | HF | HCN | H2CO3 |
| 电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
(1)c(H+)相同的三种酸溶液的浓度从大到小为
(2)若HCN溶液的起始浓度为0.01mol·L-1,平衡时c(H+)约为
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a
(4)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为
(5)设计实验证明氢氟酸比HCl的酸性弱
19-20高二下·北京·课时练习
类题推荐
常温下,部分酸的电离常数如表所示。
(1)pH相同的三种酸,物质的量浓度从大到小的顺序为________ 。
(2)若HCN的起始浓度为0.1mol•L-1,平衡时c(H+)约为________ mol•L-1,使此溶液中HCN的电离程度增大且c(H+)也增大的方法是________ 。
(3)中和等量的NaOH,消耗等pH的HF和H2SO4的体积分别为aL、bL,则a________ b(填“大于”“小于”或“等于”)。
(4)向NaCN溶液中通入少量CO2,发生反应的离子方程式为________ 。
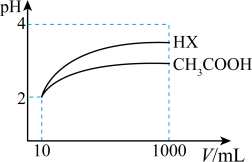
(5)25℃时,将体积均为10mL、pH均为2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程中pH的变化如图,则HX的电离平衡常数________ (填“大于”“小于”或“等于”,下同)醋酸的电离平衡常数,稀释后,HX溶液中水电离出来的c(H+)________ 醋酸溶液中水电离出来的c(H+)。
| 化学式 | HF | HCN | H2CO3 |
| 电离常数 | Ka=3.5×10-4 | Ka=3.6×10-10 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
(2)若HCN的起始浓度为0.1mol•L-1,平衡时c(H+)约为
(3)中和等量的NaOH,消耗等pH的HF和H2SO4的体积分别为aL、bL,则a
(4)向NaCN溶液中通入少量CO2,发生反应的离子方程式为
(5)25℃时,将体积均为10mL、pH均为2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程中pH的变化如图,则HX的电离平衡常数

常温下,部分酸的电离常数如表所示
(1)c(H+)相同的三种酸,其酸的浓度从大到小顺序为_____________ 。
(2)若HCN的起始浓度为0.1mol·L-1,平衡时c(H+)约为_____________ mol·L-1。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为a L、b L,则a_____________ b (填“大于”“小于”或“等于”)。
(4)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_____________ 。
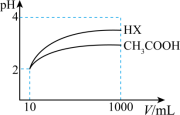
(5)25℃时,体积为10mL、pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数_____________ (填“大于”“小于”或“等于”,下同)醋酸的电离平衡常数
稀释后,HX溶液中水电离出来的c(H+)_____________ 醋酸溶液中水电离出来的c(H+)。
| 化学式 | HF | HCN | H2CO3 |
| 电离常数 | Ka=3.5×10-4 | Ka=3.6×10-10 | Ka1=4.3×10-7,Ka2=4.7×10-11 |
(2)若HCN的起始浓度为0.1mol·L-1,平衡时c(H+)约为
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为a L、b L,则a
(4)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为
(5)25℃时,体积为10mL、pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数
稀释后,HX溶液中水电离出来的c(H+)

常温下,部分酸的电离常数如表所示。
(1)pH相同的三种酸,物质的量浓度从大到小的顺序为______ 。
(2)使此溶液中HCN的电离程度增大且c( )也增大的方法是
)也增大的方法是______ 。
(3)中和等量的NaOH,消耗等pH的HF和H2SO4;的体积分别为aL、bL,则a______ b(填“大于”“小于”或“等于”)。
(4)向NaCN溶液中通入少量CO2,发生反应的离子方程式为____________ 。
(5)已知t ℃时,0.01mol/L NaOH溶液的pH=10,0.1mol/L的HA溶液中 =
= 。则该温度下,0.1mol/L的HA溶液中水电离出c(
。则该温度下,0.1mol/L的HA溶液中水电离出c( )=
)=______ mol/L。该温度下,100mL pH=a的稀硫酸与10mL pH=b的NaOH溶液混合,溶液呈中性,则a、b的关系为______ 。
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5× | Ka=3.6× | Ka1=4.3× |
(2)使此溶液中HCN的电离程度增大且c(
(3)中和等量的NaOH,消耗等pH的HF和H2SO4;的体积分别为aL、bL,则a
(4)向NaCN溶液中通入少量CO2,发生反应的离子方程式为
(5)已知t ℃时,0.01mol/L NaOH溶液的pH=10,0.1mol/L的HA溶液中
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


