解答题-原理综合题 适中0.65 引用1 组卷167
“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对工业生产、缓解环境污染、解决能源危机等具有重要意义。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原氧化铁的热化学方程式为_____________ 。
(2)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
①煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为_______ ;
②常温下,0.1mol·L-1 NaHCO3溶液和0.1mol·L-1 NaHS溶液的pH相比,pH较小的为________ 溶液(填化学式)。
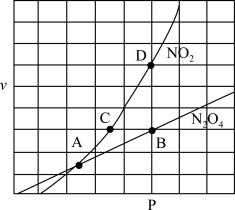
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生反应:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) ΔH (此反应在低温时为自发反应)。
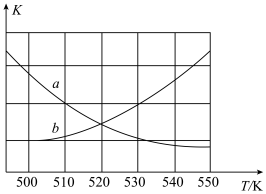
①下图能表示该反应的平衡常数K与温度T之间的变化关系曲线为_____ (填“a”或“b”),其判断依据是__________ 。
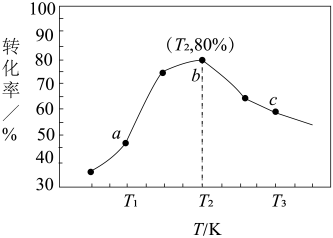
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如下图所示,则在该时间段内,恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为_____________ 。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成28g N2时,转移的电子数为____ mol(结果保留三位有效数字)。
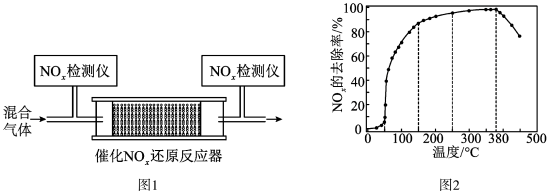
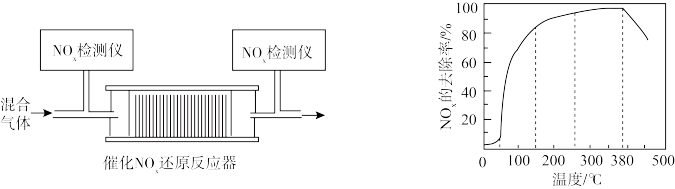
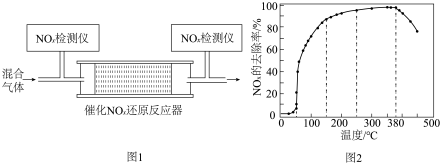
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置如图1)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是______ ;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是____ 。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原氧化铁的热化学方程式为
(2)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
| H2CO3 | H2S | |
| Ka1 | 4.410-7 | 1.310-7 |
| Ka2 | 4.710-11 | 7.110-15 |
①煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
②常温下,0.1mol·L-1 NaHCO3溶液和0.1mol·L-1 NaHS溶液的pH相比,pH较小的为
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生反应:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) ΔH (此反应在低温时为自发反应)。
①下图能表示该反应的平衡常数K与温度T之间的变化关系曲线为

②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如下图所示,则在该时间段内,恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为

(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成28g N2时,转移的电子数为
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置如图1)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是

2020·湖北襄阳·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网