解答题-实验探究题 适中0.65 引用1 组卷241
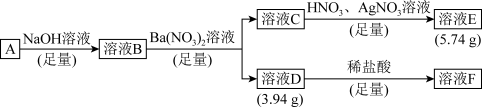
I.由三种元素组成的化合物A,式量在200- -300之间。在一 定条件下A能发生如下图的转化,其中B的焰色反应为紫色(透过蓝色钴玻璃),C是不溶于酸的白色沉淀。
请回答∶
(1) C的化学式是______ ,组成A的三种元素是________ 。
(2) A加热分解的化学方程式是_____ 。
(3) E可以和SCl2反应生成一种常用于有机合成的物质SOCl2和另一种常见气体,反应的化学方程式是________ 。
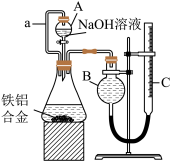
II.实验室测定某铁铝合金中的铝含量,利用如图装置和试剂完成。
请回答∶
(1)下列有关该实验的说法中正确的是_______ 。
A.由于恒压分液漏斗的存在,该装置不能进行气密性检查
B.读数前需将量气管C上下移动使B、C中的液面相平
C.反应完成后生成的氢气都要转移至装置B中
D.需要控制NaOH的量以防止产生气体过多超过量气装置的量程
(2)若将恒压分液漏斗(A) 去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量______ ,(填“偏大”、“偏小”或“不变”),请说明理由_____ 。

请回答∶
(1) C的化学式是
(2) A加热分解的化学方程式是
(3) E可以和SCl2反应生成一种常用于有机合成的物质SOCl2和另一种常见气体,反应的化学方程式是
II.实验室测定某铁铝合金中的铝含量,利用如图装置和试剂完成。

请回答∶
(1)下列有关该实验的说法中正确的是
A.由于恒压分液漏斗的存在,该装置不能进行气密性检查
B.读数前需将量气管C上下移动使B、C中的液面相平
C.反应完成后生成的氢气都要转移至装置B中
D.需要控制NaOH的量以防止产生气体过多超过量气装置的量程
(2)若将恒压分液漏斗(A) 去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量
2020·浙江温州·三模
类题推荐
I.某同学将铁铝合金样品溶解后取样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5℃,微溶于水。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
完成下列填空:
(1)操作A的名称是_______ 。经操作A后,请设计实验方案判断Fe3+是否有残留_______ 。
(2)滴定前,加入适量溶液B进行酸化,则B可能是_______ 。
a.H2SO3-H3PO4 b. H2SO4-H3PO4
c. HNO3-H3PO4 d. HI-H3PO4
(3)滴定达到终点时,消耗0.1000 mol·L-1 K2Cr2O7溶液6.00 mL(生成物中Cr元素为+3价)。根据该实验数据,试样X中c(Fe3+)为_______ 。
(4)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是_______。
II.利用下图装置和试剂可以测定铁铝合金样品中的铝含量。

请回答:
(5)下列有关该实验的说法中正确的是_______。
(6)若将恒压分液漏斗(A)去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量_______ ,(填“偏大”、“偏小”或“不变”),请说明理由_______ 。

已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5℃,微溶于水。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
完成下列填空:
(1)操作A的名称是
(2)滴定前,加入适量溶液B进行酸化,则B可能是
a.H2SO3-H3PO4 b. H2SO4-H3PO4
c. HNO3-H3PO4 d. HI-H3PO4
(3)滴定达到终点时,消耗0.1000 mol·L-1 K2Cr2O7溶液6.00 mL(生成物中Cr元素为+3价)。根据该实验数据,试样X中c(Fe3+)为
(4)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是_______。
| A.稀释被测试样 | B.减少被测试样取量 |
| C.增加平行测定次数 | D.降低滴定剂浓度 |
II.利用下图装置和试剂可以测定铁铝合金样品中的铝含量。

请回答:
(5)下列有关该实验的说法中正确的是_______。
| A.由于恒压分液漏斗的存在,该装置不能进行气密性检查 |
| B.读数前需将量气管C上下移动使B、C中的液面相平 |
| C.反应完成后生成的氢气都要转移至装置B中 |
| D.需要控制NaOH的量以防止产生气体过多超过量气装置的量程 |
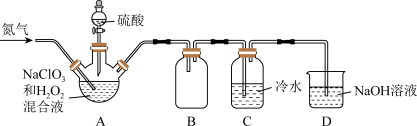
铝热反应是铝的一个重要性质。某校化学兴趣小组同学,取磁性氧化铁在如图实验装置进行铝热反应,冷却后得到“铁块”混合物。

(1)取反应后的“铁块”研碎取样称量,加入如图装置滴入足量NaOH溶液充分反应,测量生成气体体积。试回答下列问题:
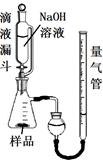
①该实验的实验目的是:测量样品中 的百分含量(填物质名称)。
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为 。
③量气管在读数时调节左右管液面相平之前的步骤是________ _。
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用。如果装置使用分液漏斗,测量出的该物质百分含量将会 (填“偏大”或“偏小”)。
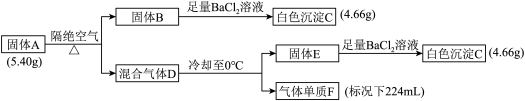
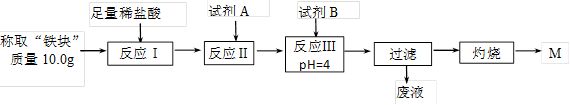
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
①试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸
B.氧化铁
C.H2O2溶液
D.氨水
E.MgCO3固体
②灼烧完全的标志是 。
③若最终红色粉未M的质量为12.0 g,则该“铁块”中铁的百分含量是 。

(1)取反应后的“铁块”研碎取样称量,加入如图装置滴入足量NaOH溶液充分反应,测量生成气体体积。试回答下列问题:

①该实验的实验目的是:测量样品中 的百分含量(填物质名称)。
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为 。
③量气管在读数时调节左右管液面相平之前的步骤是________ _。
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用。如果装置使用分液漏斗,测量出的该物质百分含量将会 (填“偏大”或“偏小”)。
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸
B.氧化铁
C.H2O2溶液
D.氨水
E.MgCO3固体
②灼烧完全的标志是 。
③若最终红色粉未M的质量为12.0 g,则该“铁块”中铁的百分含量是 。
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网