解答题-工业流程题 较难0.4 引用1 组卷239
铋(Bi)是一种稀有金属,目前世界年产量约4000t左右。铋的主要用途是制造易熔合金,作为冶金添加剂及制药工业等方面。铋的冶炼分为粗炼和精炼两个阶段:
Ⅰ.粗炼
Ⅱ.精炼

回答下列问题:
(1)铋在元素周期表中的位置是_______________ 。
(2)①还原熔炼法中还需加入一定量造渣剂(纯碱)使其与矿石中的脉石(主要为Al2O3)形成熔渣,写出形成熔渣反应的化学反应方程式______________________________ 。
②对于混合精矿,矿料中的Bi2S3和Bi2O3可在高温下彼此进行氧化还原反应生产粗铋,写出此反应的化学反应方程式______________________________ 。
③有些硫化铋矿也可用湿法处理,即加入三氯化铁与盐酸的混合液,可溶解硫化铋和少量天然铋,这是利用了_______________________________ 。
(3)电解精炼时,以_______ 作为阳极,__________ 作为阴极,电解液一般用FeCl3/HCl。此时电解出的铋还含有砷、锑、碲杂质,需进一步除去:
①除砷、锑
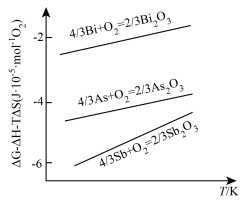
在熔融粗铋中通入空气,砷、锑将优先氧化为As2O3及Sb2O3,根据上图分析其原因是________________________________ 。
②除碲:向除砷、锑后的熔铋中继续鼓入空气并加入NaOH,杂质碲被氧化为TeO2随即被NaOH吸入形成亚碲酸钠,写出吸入反应的离子反应方程式_______________________ 。
Ⅰ.粗炼
| 辉铋矿(Bi2S3) | 铋华(Bi2O3) | 混合精矿(Bi2S3/ Bi2O3) |
| 沉淀熔炼 | 还原熔炼 | 混合熔炼 |
Ⅱ.精炼
回答下列问题:
(1)铋在元素周期表中的位置是
(2)①还原熔炼法中还需加入一定量造渣剂(纯碱)使其与矿石中的脉石(主要为Al2O3)形成熔渣,写出形成熔渣反应的化学反应方程式
②对于混合精矿,矿料中的Bi2S3和Bi2O3可在高温下彼此进行氧化还原反应生产粗铋,写出此反应的化学反应方程式
③有些硫化铋矿也可用湿法处理,即加入三氯化铁与盐酸的混合液,可溶解硫化铋和少量天然铋,这是利用了
(3)电解精炼时,以
①除砷、锑

在熔融粗铋中通入空气,砷、锑将优先氧化为As2O3及Sb2O3,根据上图分析其原因是
②除碲:向除砷、锑后的熔铋中继续鼓入空气并加入NaOH,杂质碲被氧化为TeO2随即被NaOH吸入形成亚碲酸钠,写出吸入反应的离子反应方程式
2020·四川凉山·三模
类题推荐
锑(Sb)及其化合物广泛用于化工生产。以粗锑氧为原料制备Sb和 的工艺流程如图所示。
的工艺流程如图所示。 ,含有
,含有 等杂质;
等杂质;
Ⅱ.浸出液主要含 和
和 ,还含有
,还含有 和
和 等杂质;
等杂质;
Ⅲ. 为两性氧化物;
为两性氧化物;
回答下列问题:
(1)已知 在熔融状态下不导电,写出
在熔融状态下不导电,写出 的电子式
的电子式___________ 。
(2)“水解”是利用 的水解反应制取
的水解反应制取 (
( 水解反应分三步,中间产物有SbOCl等)。为了促进水解趋于完全,操作时将
水解反应分三步,中间产物有SbOCl等)。为了促进水解趋于完全,操作时将 慢慢加入大量水中,反应后期还有加入少量氨水。试结合平衡移动原理解释这两项操作的用:
慢慢加入大量水中,反应后期还有加入少量氨水。试结合平衡移动原理解释这两项操作的用:___________ 。
(3)“过滤”得到滤渣成分SbOCl,加氨水对其“除氯”的离子反应方程式为:___________ 。
(4)为提高 的纯度,需要洗掉“滤渣Ⅱ”表面的
的纯度,需要洗掉“滤渣Ⅱ”表面的 ,最好选取的洗涤剂是___________(填标号)。
,最好选取的洗涤剂是___________(填标号)。
(5)“沉锌”时,若溶液中 ,会逸出
,会逸出 气体,影响“沉锌”的顺利进行。则要使
气体,影响“沉锌”的顺利进行。则要使 沉淀完全,溶液中的
沉淀完全,溶液中的 最大为
最大为___________  。(已知:①25℃时,
。(已知:①25℃时, ;②溶液中离子浓度:
;②溶液中离子浓度: 时,认为沉淀完全。)
时,认为沉淀完全。)
(6)“除砷”时有 生成(不含其他含P微粒),该反应的化学方程式为
生成(不含其他含P微粒),该反应的化学方程式为___________ 。
(7)某企业对粗铜精炼阳极泥中锑元素进行回收。
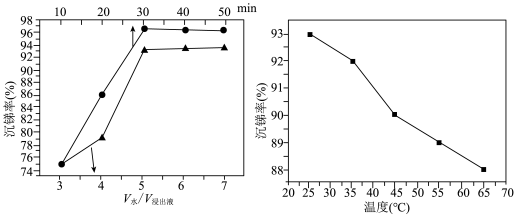
经硫酸和氯化钠浸出后的Sb(Ⅲ)在一定条件下可发生水解反应进而沉淀出锑,为了寻求最佳沉锑条件,分别对水解时间、浸出液稀释倍数、温度等因素进行探究,结果如图所示。水解沉锑的最佳条件为___________ 。
Ⅱ.浸出液主要含
Ⅲ.
回答下列问题:
(1)已知
(2)“水解”是利用
(3)“过滤”得到滤渣成分SbOCl,加氨水对其“除氯”的离子反应方程式为:
(4)为提高
| A.NaOH溶液 | B. | C.KOH溶液 | D.NaCl溶液 |
(5)“沉锌”时,若溶液中
(6)“除砷”时有
(7)某企业对粗铜精炼阳极泥中锑元素进行回收。
经硫酸和氯化钠浸出后的Sb(Ⅲ)在一定条件下可发生水解反应进而沉淀出锑,为了寻求最佳沉锑条件,分别对水解时间、浸出液稀释倍数、温度等因素进行探究,结果如图所示。水解沉锑的最佳条件为
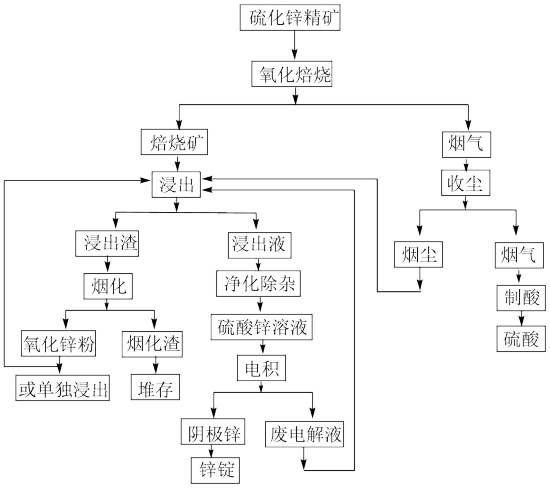
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。湿法炼锌是用稀硫酸(即废电解液)浸出锌焙烧矿得硫酸锌溶液,经净化后用电积的方法将锌从溶液中提取出来。某硫化锌精矿akg(ZnS:b%,还含FeS、PhS、CbS等)冶炼Zn的工艺流程如图:
回答下列问题:
(1)用空气或富氧在高温下使锌精矿中ZnS氧化成ZnO和ZnSO4,若生成等物质的量的ZnO和ZnSO4,请写出该反应的化学方程式____ 。
(2)用30~60g/L硫酸作浸出液,配制49g/L的硫酸1000mL,需质量分数为98%、ρ=1.84g/cm3的浓硫酸____ mL(保留三位有效数字),影响浸出的因素有____ (答两点即可)。
(3)净化除杂包括除铁和除镉两个过程,除铁需要调节pH的范围为____ ,其该过程产生的沉淀为____ ;除去ZnSO4溶液中的Cd2+可利用置换原理,则加入的试剂为____ 。
该工艺条件下,相关金属离子[c0(M2+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
(4)经过净化后的硫酸锌溶液加入添加剂,通过高位槽连续送入电解槽,槽中布以不溶性铅钙合金阳极和铝阴极。写出阴极的电极反应式____ ;Zn作为碱性锌锰电池的负极,写出该负极的电极反应式____ 。
(5)氧化焙烧的烟气主要成分为____ ,最终可制得硫酸,该硫酸可以在____ 步骤中循环使用。
(6)通过此流程得到的Zn的质量为ckg,根据上述数据____ (填:“能”或“不能”)计算出产率,请说明理由:____ 。

回答下列问题:
(1)用空气或富氧在高温下使锌精矿中ZnS氧化成ZnO和ZnSO4,若生成等物质的量的ZnO和ZnSO4,请写出该反应的化学方程式
(2)用30~60g/L硫酸作浸出液,配制49g/L的硫酸1000mL,需质量分数为98%、ρ=1.84g/cm3的浓硫酸
(3)净化除杂包括除铁和除镉两个过程,除铁需要调节pH的范围为
该工艺条件下,相关金属离子[c0(M2+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
(4)经过净化后的硫酸锌溶液加入添加剂,通过高位槽连续送入电解槽,槽中布以不溶性铅钙合金阳极和铝阴极。写出阴极的电极反应式
(5)氧化焙烧的烟气主要成分为
(6)通过此流程得到的Zn的质量为ckg,根据上述数据
铋是一种绿色稀有金属,铋及其化合物在工业生产中用途广泛,工业上常采用粗铋精炼制得用途更为广泛的精炼铋( 含铋99.995% ),火法精炼铋的工艺流程如下:
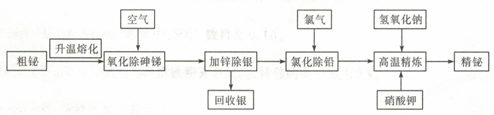
已知:①粗铋(铅铋合金)的主要化学成分如下表:
②氯化铅熔点为498℃,密度为5.9g/cm3;铋的熔点为271℃,沸点为1470 ℃;BiCl3的熔点为506.5℃。
③锌酸盐简写成ZnO22-,如锌酸钠Na2ZnO2。
④+3价铋的化合物较为稳定,铋酸钠难溶于水。
回答下列问题:
(1)实验室中升温熔化粗铋一般用酒精喷灯在________ (填主要仪器名称)中完成。
(2)NaBiO3中铋元素的化合价为________ 。
(3)“氧化除砷锑”的工艺机理是粗铋熔融液在680~750℃的条件下,鼓入压缩空气,使砷、锑氧化挥发,同时空气也与铋液反应,利用Bi2O3的_______ 性将杂质砷、锑转变成As2O3、Sb2O3而除去。
(4)“氯化除铅”过程中,氯气与铅、铋反应分别生成PbCl2、BiCl3,生成的BiCl3又会被铅还原,发生反应3Pb+2BiCl3=3PbC12+2Bi,控制温度350-400℃,利用熔点和密度特点,氯化铅上浮至铋液表面呈_______ 态覆盖,防止氯气__________________ 。
(5)高温精炼的实质为碱性精炼,加入少量KNO3 和NaOH,将锌氧化成锌酸盐而除去残锌,同时得到氮气,写出高温精炼的化学方程式:__________________ 。
(6)向含有MnSO4的酸性溶液中加入铋酸钠粉末,溶液变为紫红色,该反应经常用来检验Mn2+,写出该反应的离子方程式__________________ 。

已知:①粗铋(铅铋合金)的主要化学成分如下表:
| 元素 | Ag | Bi | Pb | As | Sb |
| 含量/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
②氯化铅熔点为498℃,密度为5.9g/cm3;铋的熔点为271℃,沸点为1470 ℃;BiCl3的熔点为506.5℃。
③锌酸盐简写成ZnO22-,如锌酸钠Na2ZnO2。
④+3价铋的化合物较为稳定,铋酸钠难溶于水。
回答下列问题:
(1)实验室中升温熔化粗铋一般用酒精喷灯在
(2)NaBiO3中铋元素的化合价为
(3)“氧化除砷锑”的工艺机理是粗铋熔融液在680~750℃的条件下,鼓入压缩空气,使砷、锑氧化挥发,同时空气也与铋液反应,利用Bi2O3的
(4)“氯化除铅”过程中,氯气与铅、铋反应分别生成PbCl2、BiCl3,生成的BiCl3又会被铅还原,发生反应3Pb+2BiCl3=3PbC12+2Bi,控制温度350-400℃,利用熔点和密度特点,氯化铅上浮至铋液表面呈
(5)高温精炼的实质为碱性精炼,加入少量KNO3 和NaOH,将锌氧化成锌酸盐而除去残锌,同时得到氮气,写出高温精炼的化学方程式:
(6)向含有MnSO4的酸性溶液中加入铋酸钠粉末,溶液变为紫红色,该反应经常用来检验Mn2+,写出该反应的离子方程式
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


