解答题-原理综合题 较难0.4 引用2 组卷488
以CH4、CO2为原料合成乙酸,是综合开发温室气体资源的新方向。
I.CH4.CO2催化重整间接制乙酸
CH4、CO2催化重整制合成气,再利用合成气制乙酸,涉及的反应如下:
反应l:CH4(g)+CO2(g) ⇌2H2(g)+2CO(g)△H
反应2:2H2(g)+CO(g) ⇌CH3OH(g)△H=-90.9kJ·mol-1
反应3:CH3OH(g)+CO(g) ⇌CH3COOH(g)△H=-118.2kJ·mol-1
(1)已知:CH4(g)+CO2(g) ⇌ CH3COOH(g)△H=+37.9kJ·mol-1则“反应l”的△H=_________
(2)“反应1”的化学反应速率v=k[ ]m·[
]m·[ ]n,k为速率常数。1123K和1173K时,分别保持
]n,k为速率常数。1123K和1173K时,分别保持 或
或 不变,测得速率v与
不变,测得速率v与 、
、 的关系如图所示:
的关系如图所示:
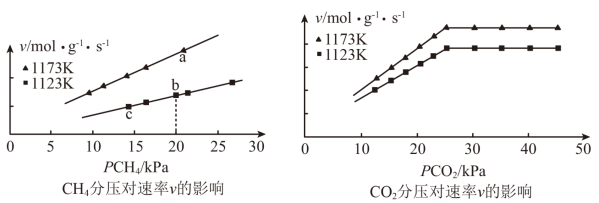
①由图可知,下列叙述正确的是_________ (填标号)。
A.当10kPa≤ ≤25kPa时,m=l
≤25kPa时,m=l
B.其他条件不变,增大 ,速率v不一定增大
,速率v不一定增大
C.a、b、c三点速率常数的大小关系为:ka>kb>kc
②若初始时按n(CH4):n(CO2)=1:1进气,且Kb=1.3×10-2mol·g-1·s-1·Kpa-2,则b点的化学反应速率v=_________ mol·g-1·s-1。
(3)向盛有催化剂的刚性容器中通入等物质的量的CH4(g)和CO2(g),发生“反应1”。在923K和1173K时,CH4(g)的转化率(α)与时间(t)的关系如图所示。
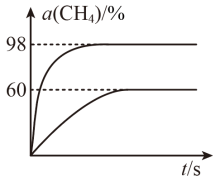
923K时,CH4(g)的平衡转化率α=_________ ,若平衡时体系的总压强为p0,平衡常数K923K=____ (用含有p0的代数式表示)。
II.CH4、CO2两步法制乙酸
(4)反应CH4(g)+CO2(g)⇌CH3COOH(g)不能自发进行。将该反应拆分成两个连续的步骤进行,可在较温和的条件下实现上述转化,具体过程:
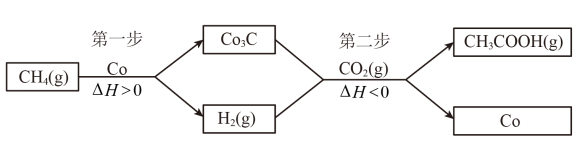
①第二步反应的化学方程式为_________
②为增大CH3COOH的平衡产率,从温度角度考虑,第一步反应在高温下进行,第二步反应在_________ 进行;从H2浓度的角度考虑,应采取的措施是_________ 。
I.CH4.CO2催化重整间接制乙酸
CH4、CO2催化重整制合成气,再利用合成气制乙酸,涉及的反应如下:
反应l:CH4(g)+CO2(g) ⇌2H2(g)+2CO(g)△H
反应2:2H2(g)+CO(g) ⇌CH3OH(g)△H=-90.9kJ·mol-1
反应3:CH3OH(g)+CO(g) ⇌CH3COOH(g)△H=-118.2kJ·mol-1
(1)已知:CH4(g)+CO2(g) ⇌ CH3COOH(g)△H=+37.9kJ·mol-1则“反应l”的△H=
(2)“反应1”的化学反应速率v=k[

①由图可知,下列叙述正确的是
A.当10kPa≤
B.其他条件不变,增大
C.a、b、c三点速率常数的大小关系为:ka>kb>kc
②若初始时按n(CH4):n(CO2)=1:1进气,且Kb=1.3×10-2mol·g-1·s-1·Kpa-2,则b点的化学反应速率v=
(3)向盛有催化剂的刚性容器中通入等物质的量的CH4(g)和CO2(g),发生“反应1”。在923K和1173K时,CH4(g)的转化率(α)与时间(t)的关系如图所示。

923K时,CH4(g)的平衡转化率α=
II.CH4、CO2两步法制乙酸
(4)反应CH4(g)+CO2(g)⇌CH3COOH(g)不能自发进行。将该反应拆分成两个连续的步骤进行,可在较温和的条件下实现上述转化,具体过程:

①第二步反应的化学方程式为
②为增大CH3COOH的平衡产率,从温度角度考虑,第一步反应在高温下进行,第二步反应在
2020·广东深圳·二模
类题推荐
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以CO2和NH3为原料合成尿素的反应为:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),该反应为放热反应。
CO(NH2)2(s)+H2O(g),该反应为放热反应。
(1)上述反应中,有利于提高CO2平衡转化率的措施是_______(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如图所示:
第一步:2NH3(g)+CO2(g) H2NCOONH4(s) ΔH1=-159.5kJ·mol-1
H2NCOONH4(s) ΔH1=-159.5kJ·mol-1
第二步:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+72.5kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.5kJ·mol-1_______ 。
②反应速率较快的是_______ 反应(填“第一步”或“第二步”),理由是_______ 。
II.以CO2和CH4催化重整制备合成气:CO2(g)+CH4(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
(3)在密闭容器中通入物质的量均为0.2mol的CH4和CO2在一定条件下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图所示。
2CO(g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图所示。_______ (填序号)。
A.反应速率:2v正(CO2)=v正(H2) B.同时断裂2mol C-H键和1mol H-H键
C.容器内混合气体的压强保持不变 D.容器中混合气体的密度保持不变
②由图可知,Y点速率v正_______ v逆(填“>”“<”或“=”,下同);容器内压强P1_______ P2。
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=_______ (用含P2的代数式表示)。
III.电化学法还原二氧化碳制取乙烯:在强酸性溶液中通入CO2气体,用惰性电极进行电解可制得乙烯。其原理如图所示:_______ 。
I.以CO2和NH3为原料合成尿素的反应为:2NH3(g)+CO2(g)
(1)上述反应中,有利于提高CO2平衡转化率的措施是_______(填序号)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
第一步:2NH3(g)+CO2(g)
第二步:H2NCOONH4(s)

②反应速率较快的是
II.以CO2和CH4催化重整制备合成气:CO2(g)+CH4(g)
(3)在密闭容器中通入物质的量均为0.2mol的CH4和CO2在一定条件下发生反应:CH4(g)+CO2(g)

A.反应速率:2v正(CO2)=v正(H2) B.同时断裂2mol C-H键和1mol H-H键
C.容器内混合气体的压强保持不变 D.容器中混合气体的密度保持不变
②由图可知,Y点速率v正
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=
III.电化学法还原二氧化碳制取乙烯:在强酸性溶液中通入CO2气体,用惰性电极进行电解可制得乙烯。其原理如图所示:

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网