解答题-原理综合题 适中0.65 引用1 组卷183
2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕。一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO) 等一碳化合物在化工 、医药,能源等方面都有着广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1molHCHO过程中能量变化如图1。
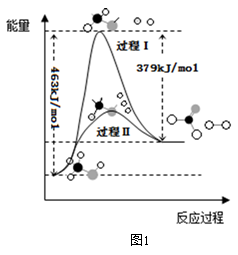
已知:CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ•mol-1,则反应CO2(g)+2H2(g)=HCHO(g) +H2O(g) △H=___________ kJ•mol-1。
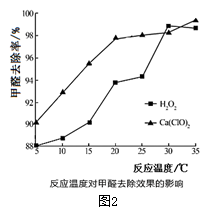
(2)氧化剂可处理甲醛污染,结合图2分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为__________ (填化学式)。
(3)纳米二氧化钛催化剂可用于工业上合成甲醇,CO2(g)+2H2(g) CH3OH(g) △H=akJ•mol-1
CH3OH(g) △H=akJ•mol-1
①按 =2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a
=2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a_____ (填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________ 。
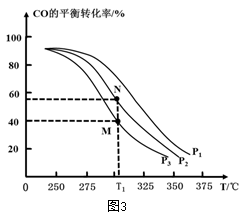
②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol•L-1。达到平衡时,CO的转化率为图3中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为__________ (保留3位有效数字)。
(4)工业上利用CH4(CO和H2)与水蒸气在一定条件下制取H2:CH4(g) +H2O(g) CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,
CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,
由上还数据可得该温度下,c2=____________ ,该反应的逆反应速率常数k=______ L3•mol-3•min-1)。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1molHCHO过程中能量变化如图1。

已知:CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ•mol-1,则反应CO2(g)+2H2(g)=HCHO(g) +H2O(g) △H=
(2)氧化剂可处理甲醛污染,结合图2分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为

(3)纳米二氧化钛催化剂可用于工业上合成甲醇,CO2(g)+2H2(g)
 CH3OH(g) △H=akJ•mol-1
CH3OH(g) △H=akJ•mol-1①按

②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol•L-1。达到平衡时,CO的转化率为图3中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为
(4)工业上利用CH4(CO和H2)与水蒸气在一定条件下制取H2:CH4(g) +H2O(g)
 CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,
CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 8.0 |
| c2 | c1 | 16.0 |
| c2 | 0.15 | 6.75 |
由上还数据可得该温度下,c2=
2020·甘肃陇南·二模
类题推荐
氢能是公认的清洁能源,作为低碳和零碳能源正在脱颖而出。
(1)甲醇为原料制取H2主要发生以下两个反应:
主要: CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H=+49 kJ•mol-1
较弱:H2(g)+CO2(g)⇌CO(g)+H2O(g)△H=+41 kJ•mol-1
①气态甲醇在催化剂作用下裂解可得到H2和CO,该反应的热化学方程式为________
②某温度下,将n(H2O)/n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p。,反应达到平衡时总压强为p,则平衡时甲醇的转化率为_______ (忽略较弱的反应)。
(2)CH4为原料制取H2的反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH
①该反应的逆反应速率表达式为:v逆=k逆·c(C0)·c3(H2),k逆为速率常数,在某温度下,测得实验数据如表:
由上述数据可得该温度下,上述反应的逆反应速率常数k逆=________ L3·mol-3·min-1。
②在体积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生反应,测得H2的体积分数与温度及压强的关系如图所示,(p1、p2为相应压强时的平衡曲线),则压强p1______ p2(填“大于”或“小于”);其判断理由是________ ;该反应的ΔH_____ 0(填“>”或“<");温度为TN℃,压强为p1或p2时,N点的正、逆反应速率比较:v正______ v逆(填“大于”、“小于”或“等于”)。N点对应温度下反应的平衡常数Kc=_______ 。
③反应CH4(g)+H2O(g) CO(g)+3H2(g)的平衡常数可用Kp(用平衡分压代替平衡浓度)表示。已知:p(A)V=n(A)RT,其中p(A)为气体A的分压、V为气体总体积.n(A)为气体A的物质的量,R为气体常数,T为热力学温度,则该反应的Kp与Kc的关系为Kp=
CO(g)+3H2(g)的平衡常数可用Kp(用平衡分压代替平衡浓度)表示。已知:p(A)V=n(A)RT,其中p(A)为气体A的分压、V为气体总体积.n(A)为气体A的物质的量,R为气体常数,T为热力学温度,则该反应的Kp与Kc的关系为Kp=______ (列出表达式并推导,结果中含Kc、R、T等)。

(1)甲醇为原料制取H2主要发生以下两个反应:
主要: CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H=+49 kJ•mol-1
较弱:H2(g)+CO2(g)⇌CO(g)+H2O(g)△H=+41 kJ•mol-1
①气态甲醇在催化剂作用下裂解可得到H2和CO,该反应的热化学方程式为
②某温度下,将n(H2O)/n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p。,反应达到平衡时总压强为p,则平衡时甲醇的转化率为
(2)CH4为原料制取H2的反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH
①该反应的逆反应速率表达式为:v逆=k逆·c(C0)·c3(H2),k逆为速率常数,在某温度下,测得实验数据如表:
| CO浓度(mol·L-1) | H2浓度(mol·L-1) | 逆反应速率(mol·L-1·min-1) |
| 0.05 | C1 | 4.8 |
| C2 | C1 | 19.2 |
| C2 | 0.15 | 8.1 |
②在体积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生反应,测得H2的体积分数与温度及压强的关系如图所示,(p1、p2为相应压强时的平衡曲线),则压强p1
③反应CH4(g)+H2O(g)
 CO(g)+3H2(g)的平衡常数可用Kp(用平衡分压代替平衡浓度)表示。已知:p(A)V=n(A)RT,其中p(A)为气体A的分压、V为气体总体积.n(A)为气体A的物质的量,R为气体常数,T为热力学温度,则该反应的Kp与Kc的关系为Kp=
CO(g)+3H2(g)的平衡常数可用Kp(用平衡分压代替平衡浓度)表示。已知:p(A)V=n(A)RT,其中p(A)为气体A的分压、V为气体总体积.n(A)为气体A的物质的量,R为气体常数,T为热力学温度,则该反应的Kp与Kc的关系为Kp=
汽车尾气是空气污染的一重大因素,汽车尾气中含有一氧化碳、二氧化碳以及氧化氮(用N2O表示)、碳氢化合物等均是空气污染源。其中一氧化碳、一氧化二氮、碳氢化合物对人体也会产生很大的不良影响。回答下列问题:
I.一氧化二氮
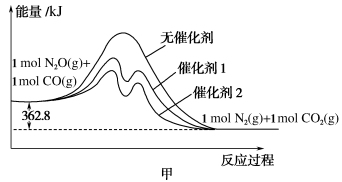
(1)用CO还原N2O的能量变化如图甲所示,则该反应的热化学方程式为_______ 。
在相同温度和压强下,1 mol N2O和1 mol CO经过相同反应时间测得如下实验数据:
试分析在相同温度时,催化剂2催化下N2O的转化率更高的原因是_______ 。
(2)在容积均为1 L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1 mol N2O、0.4 mol CO和相同催化剂。实验测得A、B容器中N2O的转化率随时间的变化关系如图乙所示。
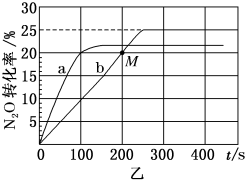
①B容器中N2O的转化率随时间的变化关系是图乙中的_______ 曲线。
②要缩短b曲线对应容器达到平衡的时间,但不改变N2O的平衡转化率,在催化剂一定的情况下可采取的措施是_______ (答出1点即可)。
③500℃该反应的化学平衡常数K=_______ (用分数表示)。
④实验测定该反应的反应速率v正=k正·c(N2O)·c(CO),v逆=k逆·c(N2)·c(CO2),k正、k逆分别是正、逆反应速率常数,c为物质的量浓度。计算M处的 =
=_______ (保留两位小数)。
II.将汽车尾气中含有的CO、CO2利用,这样不仅能有效利用资源,还能防治空气污染。
甲醇是重要的化工基础原料和清洁液体燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如下表所示:
(3)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______ (填字母)。
a.平衡正向移动
b.混合气体的平均相对分子质量增大
c.CO2的转化率增大
(4)K1、K2、K3的关系是:K3=_______ 。
(5)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.2、0.1、0.01、0.2,则此时v正_______ v逆(填“>”“=”或“<”)。
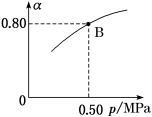
(6)某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如图所示,若开始加入2 mol·L-1H2和1 mol·L-1CO,则B点时化学平衡常数为_______ 。
(7)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如下表所示。其中甲经2 min达平衡,平衡时c(H2O)=0.05 mol·L-1,甲中CO2的转化率为_______ ,乙中CO2的转化率_______ 甲。(填“大于”“等于”或“小于”)
I.一氧化二氮
(1)用CO还原N2O的能量变化如图甲所示,则该反应的热化学方程式为

在相同温度和压强下,1 mol N2O和1 mol CO经过相同反应时间测得如下实验数据:
| 实验 | 温度/℃ | 催化剂 | N2O转化率/% |
| 实验1 | 400 | 催化剂1 | 9.5 |
| 400 | 催化剂2 | 10.6 | |
| 实验2 | 500 | 催化剂1 | 12.3 |
| 500 | 催化剂2 | 13.5 |
试分析在相同温度时,催化剂2催化下N2O的转化率更高的原因是
(2)在容积均为1 L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1 mol N2O、0.4 mol CO和相同催化剂。实验测得A、B容器中N2O的转化率随时间的变化关系如图乙所示。

①B容器中N2O的转化率随时间的变化关系是图乙中的
②要缩短b曲线对应容器达到平衡的时间,但不改变N2O的平衡转化率,在催化剂一定的情况下可采取的措施是
③500℃该反应的化学平衡常数K=
④实验测定该反应的反应速率v正=k正·c(N2O)·c(CO),v逆=k逆·c(N2)·c(CO2),k正、k逆分别是正、逆反应速率常数,c为物质的量浓度。计算M处的
II.将汽车尾气中含有的CO、CO2利用,这样不仅能有效利用资源,还能防治空气污染。
甲醇是重要的化工基础原料和清洁液体燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)⇌CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)⇌H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)⇌CH3OH(g)+H2O(g) | K3 | ||
a.平衡正向移动
b.混合气体的平均相对分子质量增大
c.CO2的转化率增大
(4)K1、K2、K3的关系是:K3=
(5)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.2、0.1、0.01、0.2,则此时v正

(6)某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如图所示,若开始加入2 mol·L-1H2和1 mol·L-1CO,则B点时化学平衡常数为
(7)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如下表所示。其中甲经2 min达平衡,平衡时c(H2O)=0.05 mol·L-1,甲中CO2的转化率为
| 起始浓度 | 甲 | 乙 |
| c(H2)/(mol·L-1) | 0.10 | 0.20 |
| c(CO2)/(mol·L-1) | 0.10 | 0.20 |
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) =CO2(g) + 3H2(g) △H = +49 kJ•mol-1
副反应:H2(g) + CO2(g) =CO(g) + H2O(g) △H=+41 kJ•mol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_____ ,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________ 。
②分析适当增大水醇比 对甲醇水蒸气重整制氢的好处是
对甲醇水蒸气重整制氢的好处是_________ 。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g) CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
①该反应逆反应速率表达式为:v逆=k•c(CO) •c3(H2),k 为速率常数,在某温度下测得实验数据如表:
由上述数据可得该温度下,该反应的逆反应速率常数 k为_____ L3•mol-3•min-1。
②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:
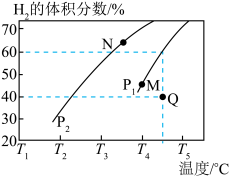
则压强Pl______ P2(填“大于”或“小于”);N点v正______ M点v逆(填“大于”或“小于”);
(3) 和
和 生成
生成 的反应为
的反应为 ,标准平衡常数
,标准平衡常数 =
= ,其中
,其中 为标准压强(
为标准压强( ),
), 、
、 和
和 为各组分的平衡分压,如
为各组分的平衡分压,如 ,
, 为平衡总压,
为平衡总压, 为平衡系统中
为平衡系统中 的物质的量分数.已知起始时向一密闭容器中投入
的物质的量分数.已知起始时向一密闭容器中投入
 和
和
 ,反应
,反应
 +
+


 在恒定温度和标准压强下进行,
在恒定温度和标准压强下进行, 的平衡产率为
的平衡产率为 ,则该反应的
,则该反应的 =
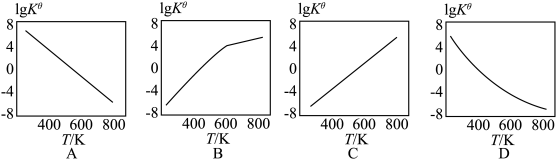
=______ (用含 的代数式表示)。下图中可以表示标准平衡常数随温度
的代数式表示)。下图中可以表示标准平衡常数随温度 的变化趋势的是
的变化趋势的是________ (填字母)
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) =CO2(g) + 3H2(g) △H = +49 kJ•mol-1
副反应:H2(g) + CO2(g) =CO(g) + H2O(g) △H=+41 kJ•mol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为
②分析适当增大水醇比
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)
①该反应逆反应速率表达式为:v逆=k•c(CO) •c3(H2),k 为速率常数,在某温度下测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.05 | c1 | 4.8 |
| c2 | c1 | 19.2 |
| c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为
②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:

则压强Pl
(3)

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


