解答题-原理综合题 适中0.65 引用1 组卷96
研究氮氧化物的反应机理,对于消除其对环境的污染具有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是 的反应速率却随着温度的升高而减小。查阅资料得知,该反应历程分为以下两步:
的反应速率却随着温度的升高而减小。查阅资料得知,该反应历程分为以下两步:
Ⅰ. (快)
(快) 
 正
正 正
正
 逆
逆 逆
逆
Ⅱ. (慢)
(慢) 
 正
正 正
正
 逆
逆 逆
逆
回答:
①反应 的
的
____ (用含 和
和 的式子表示)。一定温度下,反应
的式子表示)。一定温度下,反应 达到平衡状态,写出用
达到平衡状态,写出用 正、
正、 逆、
逆、 正、
正、 逆表示的平衡常数表达式
逆表示的平衡常数表达式
____ 。
②决定 反应速率的是反应Ⅱ,则反应Ⅰ的活化能
反应速率的是反应Ⅱ,则反应Ⅰ的活化能 与反应Ⅱ的活化能
与反应Ⅱ的活化能 的大小关系为
的大小关系为
____  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(2)亚硝酸氯( )是有机合成中重要的试剂,可
)是有机合成中重要的试剂,可 与
与 在一定条件下合成。在
在一定条件下合成。在 容器恒温条件下,将物质的量之和为
容器恒温条件下,将物质的量之和为 的
的 和
和 以不同的氮氯比进行如下反应:
以不同的氮氯比进行如下反应:
 ,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如下图。
,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如下图。
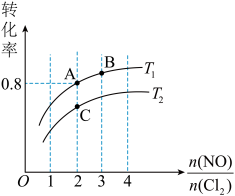
①判断图中温度 、
、 的关系:
的关系:
____  。(填“
。(填“ ”、“
”、“ ”或“
”或“ ”)
”)
②图中纵坐标为物质____ (填化学式)的转化率,理由是_____ 。
③图中 、
、 、
、 三点中平衡时
三点中平衡时 体积分数最大的是
体积分数最大的是____ 。(填“ ”、“
”、“ ”或“
”或“ ”)
”)
④ 温度下,该反应的平衡常数
温度下,该反应的平衡常数
____ 。
(1)升高温度,绝大多数的化学反应速率增大,但是
Ⅰ.
Ⅱ.
回答:
①反应
②决定
(2)亚硝酸氯(

①判断图中温度
②图中纵坐标为物质
③图中
④
2020·青海西宁·二模
类题推荐
氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
Ⅰ.一定条件下(T ℃、1.01×105 Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:
写出该反应的热化学方程式:___________________________________________ 。
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) 2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比
2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
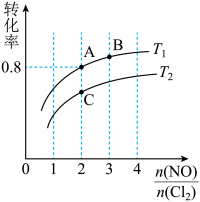
(1)图中T1、T2的关系为T1________ T2(填“>”“<”或“=”)。
(2)图中纵坐标为物质________ 的转化率,理由为_________________________________ 。
(3)图中A、B、C三点对应的NOCl体积分数最大的是________ (填“A”“B”或“C”)。
(4)若容器容积为1 L,经过10min到达A点,该时间段内化学反应速率υ(NO)=_________ 。B点的平衡常数为________ 。
(5)若在温度为T1,容积为1 L的容器中,充入0.5mol NO、1mol Cl2、2mol NOCl,υ(正)_____ υ(逆) (填“<”“>”或“=”),理由为________________________________
Ⅰ.一定条件下(T ℃、1.01×105 Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能/kJ/mol | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式:
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g)
 2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比
2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比
(1)图中T1、T2的关系为T1
(2)图中纵坐标为物质
(3)图中A、B、C三点对应的NOCl体积分数最大的是
(4)若容器容积为1 L,经过10min到达A点,该时间段内化学反应速率υ(NO)=
(5)若在温度为T1,容积为1 L的容器中,充入0.5mol NO、1mol Cl2、2mol NOCl,υ(正)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网