解答题-结构与性质 适中0.65 引用1 组卷166
K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
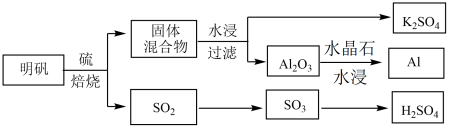
焙烧明矾的化学方程式为_________________________________________________ 。
(2)K位于元素周期表第________ 周期第________ 族。
(3)S的基态原子核外有________ 个未成对电子;Cl的基态原子核外电子排布式为____________ 。
(4)用“>”或“<”填空:
(5)SO2的价层电子对个数是________ ,该分子为结构为________ ;SO3中硫原子采用杂化方式为___________ 。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________ 个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________ g·cm-3(列出计算式子,不必计算出结果)。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:

焙烧明矾的化学方程式为
(2)K位于元素周期表第
(3)S的基态原子核外有
(4)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| O | Cl- | KCl | H2SO4 |
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度
2020·天津和平·二模
类题推荐
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的过程如下图所示:
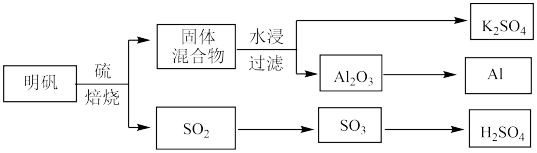
(1) S的基态原子核外有______ 个未成对电子;Cl 的基态原子核外电子排布式为________ 。
(2)用“>”或“<”填空:
(3) SO2分子构型为__________ ;SO3中硫原子采用杂化方式为__________ ;写出与SO3互为等电子体的一种离子:______________ 。
(4) Al单质为面心立方晶体,其晶胞参数a=0.405 nm,则Al的密度ρ=____ g·cm -3(只需列出计算式,不必计算出结果)。

(1) S的基态原子核外有
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| O | Cl- | KCl | H2SO4 |
(3) SO2分子构型为
(4) Al单质为面心立方晶体,其晶胞参数a=0.405 nm,则Al的密度ρ=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


