解答题-原理综合题 较难0.4 引用3 组卷533
乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g) 2
2 (g) △H1=-206.6kJ•mol-1
(g) △H1=-206.6kJ•mol-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2 (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)反应III:△S(填“>”“<”或“=”)___ 0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ•g-1,则△H3=___ kJ•mol-1
(3)实验测得2CH2=CH2(g)+O2(g) 2
2 (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2( ),v正=k正•c2(CH2=CH2)•c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正•c2(CH2=CH2)•c(O2)(k正、k逆为速率常数,只与温度有关)。
①反应达到平衡后,仅降低温度,下列说法正确的是( )
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
②若在1L的密闭容器中充入1molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,经过10min反应达到平衡,体系的压强变为原来的0.875倍,则0~10min内v(O2)=___ , =
=___ 。
(4)现代制备乙烯常用乙烷氧化裂解法:
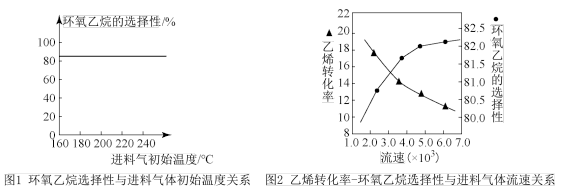
C2H6(g)+ O2(g)=C2H4(g)+H2O(g) △H2=-110kJ•mol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图为温度对乙烷氧化裂解反应性能的影响。
O2(g)=C2H4(g)+H2O(g) △H2=-110kJ•mol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图为温度对乙烷氧化裂解反应性能的影响。
①乙烷的转化率随温度的升高而升高的原因是___ ;反应的最佳温度为___ (填序号)。
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯选择性= ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
②工业上,保持体系总压恒定为l00kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___ 。
已知:I.2CH2=CH2(g)+O2(g)
 2
2 (g) △H1=-206.6kJ•mol-1
(g) △H1=-206.6kJ•mol-1II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2
 (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3(1)反应III:△S(填“>”“<”或“=”)
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ•g-1,则△H3=
(3)实验测得2CH2=CH2(g)+O2(g)
 2
2 (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2( ),v正=k正•c2(CH2=CH2)•c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正•c2(CH2=CH2)•c(O2)(k正、k逆为速率常数,只与温度有关)。①反应达到平衡后,仅降低温度,下列说法正确的是
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
②若在1L的密闭容器中充入1molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,经过10min反应达到平衡,体系的压强变为原来的0.875倍,则0~10min内v(O2)=
(4)现代制备乙烯常用乙烷氧化裂解法:
C2H6(g)+

①乙烷的转化率随温度的升高而升高的原因是
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯选择性=
②工业上,保持体系总压恒定为l00kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是
2020·福建厦门·二模
类题推荐
乙烯是一种重要的化工原料,可由乙烷为原料制取。请回答下列问题:
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
C2H6(g)+ O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知水的汽化热为H2O(l)=H2O(g) ΔH3=+44kJ·mol-1
且反应相关的部分化学键键能数据如下:
①由此计算x=___ ,通过比较ΔH1和ΔH2,说明氧化裂解法中通入氧气的作用是___ 。
②其他条件相同,对于氧化裂化法制乙烯的反应中,实验测得在T1和P1与T2和P2条件下该反应的C2H6平衡转化率相同,若T1>T2,则P1___ P2(填“>”、“<”或“=”)。
③请求出下列反应的反应热:C2H6(g)+ O2(g)=C2H4(g)+H2O(l) ΔH3=
O2(g)=C2H4(g)+H2O(l) ΔH3=___ 。
(2)一定条件下,在体积为2L的密闭容器中,充入1molC2H6发生传统裂解法制乙烯。
①某温度下,10min后该反应达平衡,此时C2H6的物质的量浓度为0.2mol·L-1,从反应开始到平衡,乙烯的平均反应速率v(C2H4)=___ 。
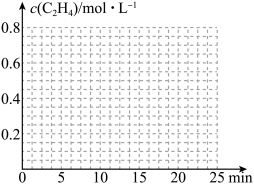
②在其它条件不变的情况下,15min时升高体系温度,20min达到新平衡,请在下边的坐标系中画出0~25 min,c(C2H4)随时间变化曲线:____ 。
(3)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是___ ;反应的最佳温度为___ (填选项序号)。
A.700℃ B.750℃ C.850℃ D.900℃

[乙烯选择性= ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(4)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中 的最佳值是
的最佳值是___ ;判断的理由是___ 。
(5)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___ 。
(6)反应达平衡时,各组分的体积分数如下表:
计算该温度下的平衡常数Kp=___ (用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
C2H6(g)+
已知水的汽化热为H2O(l)=H2O(g) ΔH3=+44kJ·mol-1
且反应相关的部分化学键键能数据如下:
| 化学键 | H-H(g) | H-O(g) | O=O(g) |
| 键能(kJ·mol-1) | 436 | X | 496 |
①由此计算x=
②其他条件相同,对于氧化裂化法制乙烯的反应中,实验测得在T1和P1与T2和P2条件下该反应的C2H6平衡转化率相同,若T1>T2,则P1
③请求出下列反应的反应热:C2H6(g)+
(2)一定条件下,在体积为2L的密闭容器中,充入1molC2H6发生传统裂解法制乙烯。
①某温度下,10min后该反应达平衡,此时C2H6的物质的量浓度为0.2mol·L-1,从反应开始到平衡,乙烯的平均反应速率v(C2H4)=
②在其它条件不变的情况下,15min时升高体系温度,20min达到新平衡,请在下边的坐标系中画出0~25 min,c(C2H4)随时间变化曲线:

(3)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是
A.700℃ B.750℃ C.850℃ D.900℃

[乙烯选择性=
(4)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中
(5)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是
(6)反应达平衡时,各组分的体积分数如下表:
| C2H6 | O2 | C2H4 | H2O | 其他物质 |
| 2.4% | 1.0% | 12% | 15% | 69.6% |
计算该温度下的平衡常数Kp=
乙烯是一种重要的基本化工原料,乙烯的产量可以衡量一个国家的石油化工发展水平,研究工业制取乙烯有重要的意义。
I.工业用H2和CO2在一定条件下合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) ΔH1
CH2=CH2(g)+4H2O(g) ΔH1
已知:①2H2(g)+O2(g)=2H2O(1) ΔH2=-571.4kJ·mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(1) ΔH3=-1411kJ·mol-1
③H2O(g)=H2O(1) ΔH4=-44kJ·mol-1
(1)ΔH1=_______
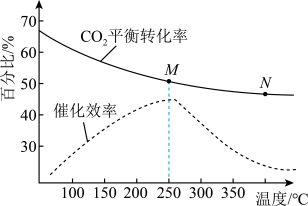
(2)在恒容密闭容器中充入体积比为3:1的H2和CO2,不同温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是_______(不定项选择)。
II.工业用甲烷催化法制取乙烯:2CH4(g) C2H4(g)+2H2(g) ΔH>0,T℃时,向4L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,T℃时,向4L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
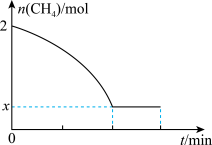
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T℃时k正与k逆的比值为____ (用含x的代数式表示);若将温度升高,速率常数增大的倍数:k正_____ (填“>”“=”或“<”)k逆。
III.乙烷裂解制乙烯:C2H6(g) C2H4(g)+H2(g)。
C2H4(g)+H2(g)。
(4)T℃时,将乙烷与氦气体积比2:1混合后,通入一恒压容器中发生反应。平衡时容器压强为P Pa,若乙烷的平衡转化率为50%,反应的平衡常数Kp=_____ (用分压表示,分压=总压×物质的量分数)。
I.工业用H2和CO2在一定条件下合成乙烯:6H2(g)+2CO2(g)
已知:①2H2(g)+O2(g)=2H2O(1) ΔH2=-571.4kJ·mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(1) ΔH3=-1411kJ·mol-1
③H2O(g)=H2O(1) ΔH4=-44kJ·mol-1
(1)ΔH1=
(2)在恒容密闭容器中充入体积比为3:1的H2和CO2,不同温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是_______(不定项选择)。

| A.为了提高乙烯的产率应尽可能选择低温 |
| B.生成乙烯的速率:v(M)可能小于v(N) |
| C.平衡常数:KM<KN |
| D.M点时的压强一定小于N点时的压强 |
II.工业用甲烷催化法制取乙烯:2CH4(g)

(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T℃时k正与k逆的比值为
III.乙烷裂解制乙烯:C2H6(g)
(4)T℃时,将乙烷与氦气体积比2:1混合后,通入一恒压容器中发生反应。平衡时容器压强为P Pa,若乙烷的平衡转化率为50%,反应的平衡常数Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 (g)
(g) (g) +5O2(g)
(g) +5O2(g) (g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2( )(k正、k逆为速率常数,只与温度有关)。
)(k正、k逆为速率常数,只与温度有关)。