解答题-原理综合题 适中0.65 引用1 组卷76
运用化学反应原理知识研究如何利用CO、 SO2等污染物有重要意义。
(1)用CO可以合成甲醇。
已知: ①CO的燃烧热△H1=-283kJ•mol-1
②N2(g)+O2(g)⇌ 2NO(g) △H2=+183kJ•mol-1
则写出CO和NO反应生成无污染气体的热化学反应方程式________ 。
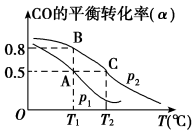
(2)一定压强下,在容积为2L的密闭容器中充入1molCO与2molH2 ,在催化剂作用下发生反应:CO(g)+2H2(g)⇌ CH3OH(g) △H ,CO转化率与温度和压强的关系如下图所示。
①反应的△H____ 0 ,p1___ p2(填>、< 或=)
②100℃时,反应进行了10秒达到平衡状态,用CO表示该反应的化学反应速率是______ ,该反应的化学平衡常数K=____ 。
③下列说法正确的是______ 。
A.若容器内气体密度恒定,反应达到平衡状态 B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,△H>0 D.反应中,催化剂使平衡向正反应方向移动
(1)用CO可以合成甲醇。
已知: ①CO的燃烧热△H1=-283kJ•mol-1
②N2(g)+O2(g)⇌ 2NO(g) △H2=+183kJ•mol-1
则写出CO和NO反应生成无污染气体的热化学反应方程式
(2)一定压强下,在容积为2L的密闭容器中充入1molCO与2molH2 ,在催化剂作用下发生反应:CO(g)+2H2(g)⇌ CH3OH(g) △H ,CO转化率与温度和压强的关系如下图所示。

①反应的△H
②100℃时,反应进行了10秒达到平衡状态,用CO表示该反应的化学反应速率是
③下列说法正确的是
A.若容器内气体密度恒定,反应达到平衡状态 B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,△H>0 D.反应中,催化剂使平衡向正反应方向移动
19-20高二上·甘肃兰州·期末
类题推荐
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g) CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。

①下列说法正确的是____________
② p2 p1 (填“大于”、“小于”或“等于”);
③ 100 ℃时,该反应的化学平衡常数K=____ ____;
(3)某科研小组用SO2为原料制取硫酸。
① 利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:___________________。
② 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式____________________________。

(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g)
 CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)
 CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
①下列说法正确的是____________
| A.若容器内气体密度恒定,反应达到平衡状态 |
| B.若容器内各气体浓度恒定,反应达到平衡状态 |
| C.上述反应中,ΔH> 0 |
| D.反应中,催化剂使平衡向正反应方向移动 |
② p2 p1 (填“大于”、“小于”或“等于”);
③ 100 ℃时,该反应的化学平衡常数K=____ ____;
(3)某科研小组用SO2为原料制取硫酸。
① 利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:___________________。
② 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式____________________________。

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
CH3OH(g) △H,CO转化率与温度、压强的关系如图所示: