解答题-工业流程题 适中0.65 引用1 组卷163
高铁酸盐是一种新型绿色净水消毒剂,热稳定性差,在碱性条件下能稳定存在,溶于水发生反应:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-。回答下列问题:
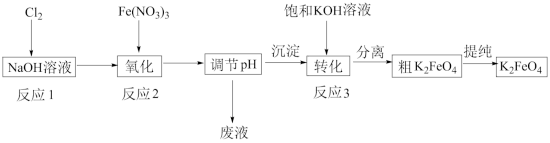
(1)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图:
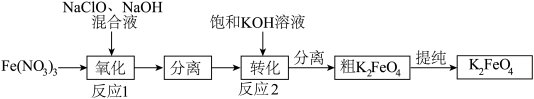
①Na2FeO4中铁元素的化合价为___ ,高铁酸钠用于杀菌消毒时的化学反应类型为___ (填“氧化还原反应”、“复分解反应”或“化合反应”)。
②反应2加入饱和KOH溶液可转化析出K2FeO4,理由是__ 。
(2)化学氧化法生产高铁酸钠(Na2FeO4)是利用Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应,该反应的化学方程式为___ ;理论上每制备0.5mol的Na2FeO4消耗NaClO的质量为___ (保留小数点后1位)。
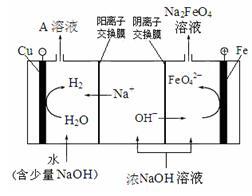
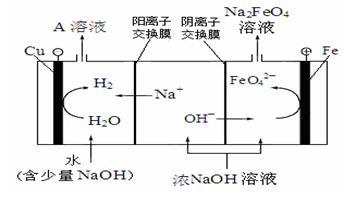
(3)采用三室膜电解技术制备Na2FeO4的装置如图甲所示,阳极的电极反应式为__ 。电解后,阴极室得到的A溶液中溶质的主要成分为___ (填化学式)。
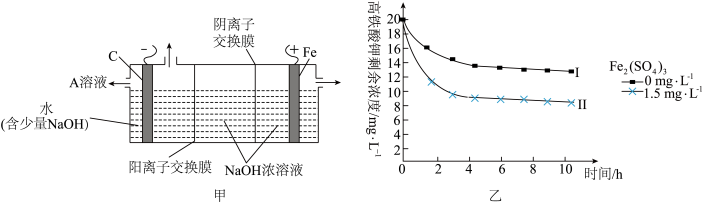
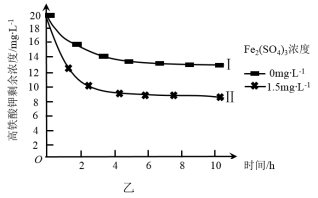
(4)将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是___ 。
(1)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图:

①Na2FeO4中铁元素的化合价为
②反应2加入饱和KOH溶液可转化析出K2FeO4,理由是
(2)化学氧化法生产高铁酸钠(Na2FeO4)是利用Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应,该反应的化学方程式为
(3)采用三室膜电解技术制备Na2FeO4的装置如图甲所示,阳极的电极反应式为

(4)将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是
2020·福建莆田·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网