解答题-原理综合题 适中0.65 引用7 组卷905
乙醇是一种重要的化工原料和燃料,常见合成乙醇的途径如下:
(1)乙烯气相直接水合法:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=akJ·mol-1
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1,则a=__ 。
(2)工业上常采用CO2和H2为原料合成乙醇,某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
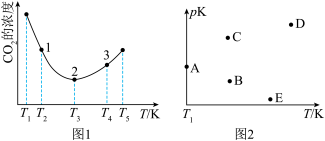
①由图1可知,b=__ (填“ ”“
”“ ”或“<”)0。
”或“<”)0。
②在T1~T2及T4~T5两个温度区间内,容器中CO2(g)的浓度呈现如图1所示的变化趋势,其原因是___ 。
③图1中点1、2、3对应的逆反应速率v1、v2、v3中最大的是___ (填“v1”“v2”或“v3”);要进一步提高H2(g)的转化率,可采取的措施有___ (任答一条)。
④图2中当温度为T1时,pK的值对应A点,则B、C、D、E四点中表示错误的是__ 。
⑤乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g) CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)
CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__ (填“ ”“
”“ ”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应
”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__ (填“正向”或“逆向”)进行。
(1)乙烯气相直接水合法:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=akJ·mol-1
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1,则a=
(2)工业上常采用CO2和H2为原料合成乙醇,某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g)

①由图1可知,b=
②在T1~T2及T4~T5两个温度区间内,容器中CO2(g)的浓度呈现如图1所示的变化趋势,其原因是
③图1中点1、2、3对应的逆反应速率v1、v2、v3中最大的是
④图2中当温度为T1时,pK的值对应A点,则B、C、D、E四点中表示错误的是
⑤乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g)
2020·河北石家庄·模拟预测
类题推荐
甲醇和乙醇都是重要的化工原料和燃料,工业上常采用CO2和H2为原料合成甲醇和乙醇。
I.某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)△H=bkJ•mol-1。反应过程持续升温,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
CH3CH2OH(g)+3H2O(g)△H=bkJ•mol-1。反应过程持续升温,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。

①由图1可知,b___ (填“>”“=”或“<”)0。
②图1中点1、2、3对应的逆反应速率v1、v2、v3中最大的是___ (填“v1”“v2”或“v3”);
③图2中当温度为T1时,pK的值对应A点,则B、C、D、E四点中表示错误的是___ 。
④乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g) CH3OCH3(g)△H=+50.7kJ•mol-1,该反应的速率方程可表示为v正=k正•c(C2H5OH)和v逆=k逆•c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)
CH3OCH3(g)△H=+50.7kJ•mol-1,该反应的速率方程可表示为v正=k正•c(C2H5OH)和v逆=k逆•c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)___ (填“>”“=”或“<”)Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应___ (填“正向”或“逆向”)进行。
II.一定温度下,将CO2和H2按如下方式充入容积均为2L的两个密闭容器中,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)∆H<0,10min后达到平衡。
CH3OH(g)+H2O(g)∆H<0,10min后达到平衡。
若甲容器平衡后气体的压强为开始时的0.8倍,则此时CO2的转化率为___ ;要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为___ 。
I.某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g)

①由图1可知,b
②图1中点1、2、3对应的逆反应速率v1、v2、v3中最大的是
③图2中当温度为T1时,pK的值对应A点,则B、C、D、E四点中表示错误的是
④乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g)
II.一定温度下,将CO2和H2按如下方式充入容积均为2L的两个密闭容器中,发生反应:CO2(g)+3H2(g)
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2、cmolCH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
乙烯是一种重要的基本化工原料,乙烯的产量可以衡量一个国家的石油化工发展水平,研究工业制取乙烯有重要的意义。
I.工业用H2和CO2在一定条件下合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) ΔH1
CH2=CH2(g)+4H2O(g) ΔH1
已知:①2H2(g)+O2(g)=2H2O(1) ΔH2=-571.4kJ·mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(1) ΔH3=-1411kJ·mol-1
③H2O(g)=H2O(1) ΔH4=-44kJ·mol-1
(1)ΔH1=_______
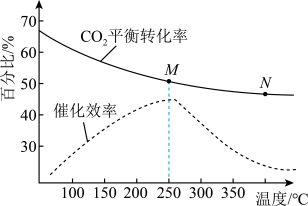
(2)在恒容密闭容器中充入体积比为3:1的H2和CO2,不同温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是_______(不定项选择)。
II.工业用甲烷催化法制取乙烯:2CH4(g) C2H4(g)+2H2(g) ΔH>0,T℃时,向4L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,T℃时,向4L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
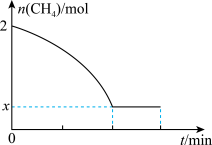
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T℃时k正与k逆的比值为____ (用含x的代数式表示);若将温度升高,速率常数增大的倍数:k正_____ (填“>”“=”或“<”)k逆。
III.乙烷裂解制乙烯:C2H6(g) C2H4(g)+H2(g)。
C2H4(g)+H2(g)。
(4)T℃时,将乙烷与氦气体积比2:1混合后,通入一恒压容器中发生反应。平衡时容器压强为P Pa,若乙烷的平衡转化率为50%,反应的平衡常数Kp=_____ (用分压表示,分压=总压×物质的量分数)。
I.工业用H2和CO2在一定条件下合成乙烯:6H2(g)+2CO2(g)
已知:①2H2(g)+O2(g)=2H2O(1) ΔH2=-571.4kJ·mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(1) ΔH3=-1411kJ·mol-1
③H2O(g)=H2O(1) ΔH4=-44kJ·mol-1
(1)ΔH1=
(2)在恒容密闭容器中充入体积比为3:1的H2和CO2,不同温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是_______(不定项选择)。

| A.为了提高乙烯的产率应尽可能选择低温 |
| B.生成乙烯的速率:v(M)可能小于v(N) |
| C.平衡常数:KM<KN |
| D.M点时的压强一定小于N点时的压强 |
II.工业用甲烷催化法制取乙烯:2CH4(g)

(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T℃时k正与k逆的比值为
III.乙烷裂解制乙烯:C2H6(g)
(4)T℃时,将乙烷与氦气体积比2:1混合后,通入一恒压容器中发生反应。平衡时容器压强为P Pa,若乙烷的平衡转化率为50%,反应的平衡常数Kp=
I.甲醇气相脱水制甲醚(CH3OCH3)的反应可表示为: 2 CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是_______。
(2)200 ℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如下表:
① 10~30 min内,用CH3OCH3(g)表示该反应的平均速率为_______ 。
② CH3OH(g)的平衡转化率为_______ 。
③ 200 ℃时,向该容器中投入三种成分的浓度如下:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)_______ v逆(CH3OH)(填“>”“<”或“=”)。
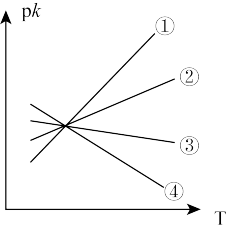
(3)若其正、逆反应速率分别可表示为v正=k正c2(CH3OH)、v逆=k逆c (CH3OCH3)·c (H2O),k正、k逆 分别为正、逆反应速率常数,只与温度有关。则如图(pk=-lgk)所示①、②、③、④四条斜线中,能表示pk正随温度T变化关系的是斜线_______ 。
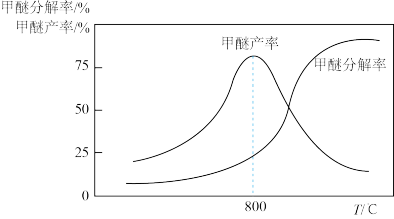
(4)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如下图所示,试解释800 ℃之后甲醇脱水制甲醚产率降低的主要原因为_______ 。
II.在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
(5)当压强从2×105增加到时5×105,平衡_______ 移动。(填“正向”、“逆向”或“不”)
(6)当压强为1×106时,写出此时反应的平衡常数表达式:K =_______ 。
(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是_______。
| A.CH3OCH3(g)和H2O(g)的浓度比保持不变 | B.v正(CH3OH)=2v逆(CH3OCH3) |
| C.容器内压强不再变化 | D.混合气体的平均相对分子质量不再变化 |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
② CH3OH(g)的平衡转化率为
③ 200 ℃时,向该容器中投入三种成分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol·L-1) | 0.64 | 0.68 | 0.68 |
(3)若其正、逆反应速率分别可表示为v正=k正c2(CH3OH)、v逆=k逆c (CH3OCH3)·c (H2O),k正、k逆 分别为正、逆反应速率常数,只与温度有关。则如图(pk=-lgk)所示①、②、③、④四条斜线中,能表示pk正随温度T变化关系的是斜线

(4)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如下图所示,试解释800 ℃之后甲醇脱水制甲醚产率降低的主要原因为

II.在容积可变的密闭容器中发生反应:mA(g)+nB(g)
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/(mol/L) | 0.08 | 0.20 | 0.44 |
(6)当压强为1×106时,写出此时反应的平衡常数表达式:K =
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


