填空题 较易0.85 引用3 组卷88
(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___ ,c(N2O5)为___ ,O2的物质的量浓度为___ 。
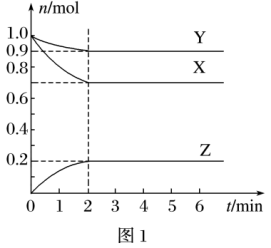
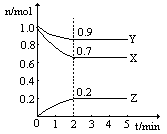
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
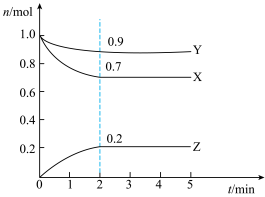
①该反应的化学方程式为___ 。
②反应至平衡时,v(X)为___ ,c(Z)为___ 。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时___ (填“增大”“减小”或“相等”)。
 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:

①该反应的化学方程式为
②反应至平衡时,v(X)为
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时
19-20高一下·吉林辽源·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网