解答题-结构与性质 较难0.4 引用1 组卷103
A、B、D、E、F、G六种元素的原子序数依次增大,除F、G为第四周期过渡元素外,其余四种均是短周期元素。已知:F的单质为生活中最常见的金属之一,原子最外层有2个电子;E原子的价电子排布为msnmpn,B原子的核外L层电子数为奇数;A、D原子p轨道的电子数分别为2和4;G基态原子的最外层电子半充满,内层全充满。请回答下列问题:
(1)F的稳定价态离子的电子排布式是___ ,A、B、D、E四种元素的第一电离能由大到小的顺序为__ (用元素符号表示)。
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是___ ,分子的立体构型为___ ,该氢化物易溶于D的简单氢化物的主要原因是___ 。
(3)D原子分别与A、B原子形成的单键中,键的极性较强的是___ (用具体的化学键表示)。
(4)如图所示的晶胞是由A、D两元素组成的,下列有关该晶体的说法中正确的是__ 。

a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
(5)G的硫酸盐溶液滴加少量氨水的离子方程式为___ ,继续滴加过量氨水的离子方程式为___ ,再加一定体积乙醇溶液析出深蓝色晶体的化学式为___ ,该晶体中包含的化学键有___ 。
(1)F的稳定价态离子的电子排布式是
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是
(3)D原子分别与A、B原子形成的单键中,键的极性较强的是
(4)如图所示的晶胞是由A、D两元素组成的,下列有关该晶体的说法中正确的是

a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
(5)G的硫酸盐溶液滴加少量氨水的离子方程式为
19-20高二下·辽宁大连·阶段练习
类题推荐
物质结构与性质填空题
表中A、B、C、D、E、F为短周期主族元素,G为第四周期元素,它们原子序数依次增大。
(1)C基态原子电子排布式为______ , 中心原子的杂化方式为
中心原子的杂化方式为______ ,分子空间构型为______ 。B,C,D三种元素的第一电离能由大到小的顺序______ 。
(2)E的最高价氧化物的VSEPR模型名称为______ ,其属于______ (填“极性”或“非极性”)分子。
(3) 的沸点比
的沸点比 的沸点高,其主要原因是
的沸点高,其主要原因是______ 。
(4)下列关于 的说法中正确的是______(填序号)。
的说法中正确的是______(填序号)。
(5)下列图像可表示两个F原子间成键后的电子云的图像是______ 。
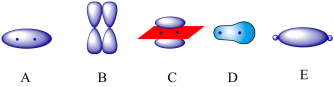
(6)向 的硫酸盐溶液中滴加氨水直至过量,首先观察到生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,加入乙醇后有深蓝色晶体析出,写出该配离子的结构简式
的硫酸盐溶液中滴加氨水直至过量,首先观察到生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,加入乙醇后有深蓝色晶体析出,写出该配离子的结构简式______ (标出配位键)。
表中A、B、C、D、E、F为短周期主族元素,G为第四周期元素,它们原子序数依次增大。
| A.元素周期表中原子半径最小的元素 |
| B.原子最外层电子数是内层电子数的2倍 |
| C.元素原子的核外p电子总数比s电子总数少1 |
| D.基态原子的价电子排布式为 |
| E.与D同主族,且原子序数为D的2倍 |
| F.元素的主族序数与周期数的差为4 |
| G.基态原子最外层电子排布为 |
(1)C基态原子电子排布式为
(2)E的最高价氧化物的VSEPR模型名称为
(3)
(4)下列关于
| A. |
| B. |
| C. |
| D. |
(5)下列图像可表示两个F原子间成键后的电子云的图像是

(6)向
下表中A、B、C、D、E、F为短周期主族元素,G为第四周期元素,它们的原子序数依次增大。
(1)C基态原子电子排布式为_______ ,CA3中心原子的杂化方式为_______ ,分子空间构型为_______ 。
(2)E的最高价氧化物的VSEPR模型名称为_______ ,其属于_______ (填“极性”或“非极性”)分子。
(3)A2D的沸点比A2E的沸点高,其主要原因是_______ 。
(4)下列关于B2A2的说法中正确的是_______ (填序号)。
A.B2A2中的所有原子都满足8电子结构
B.B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子发生加成反应σ键断裂
(5)下列图象可表示两个F原子间成键后的电子云的图象是_______ 。
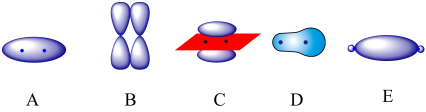
(6)向G2+的硫酸盐溶液中滴加氨水直至过量,首先观察到生成蓝色沉淀,离子方程式为_______ ,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,加入乙醇后有深蓝色晶体析出,其溶质的化学式为_______ (不用写结晶水)。
| A.元素周期表中原子半径最小的元素 |
| B.原子最外层电子数是内层电子数的2倍 |
| C.元素原子的核外p电子总数比s电子总数少1 |
| D.元素价电子排布式为nsnnp2n |
| E.同D主族元素,且原子序数为D的2倍 |
| F.元素的主族序数与周期数的差为4 |
| G.基态原子最外层电子排布为4s1,内层处于全充满状态 |
(2)E的最高价氧化物的VSEPR模型名称为
(3)A2D的沸点比A2E的沸点高,其主要原因是
(4)下列关于B2A2的说法中正确的是
A.B2A2中的所有原子都满足8电子结构
B.B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子发生加成反应σ键断裂
(5)下列图象可表示两个F原子间成键后的电子云的图象是

(6)向G2+的硫酸盐溶液中滴加氨水直至过量,首先观察到生成蓝色沉淀,离子方程式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



